Памятка для экспортеров Узбекистана: контроль качества лекарственных средств и регулирование цен на фармацевтическую продукцию в странах СНГ
Памятка для экспортеров Узбекистана:
контроль качества лекарственных средств и регулирование цен на фармацевтическую продукцию в странах СНГ
В современной производственной индустрии, затрагивающей напрямую здоровье населения, государственное регулирование фармацевтической отрасли является одной из приоритетных задач в области здравоохранения и, соответственно, не может быть упрощенной - в странах СНГ, как во всех цивилизованных странах, фармацевтическая отрасль регламентируется большим количеством законодательных актов, постановлений, руководств и приказов, гарантирующих населению качество и эффективность, а также - гарантированную доступность жизненно важных лекарственных средств, включая - непрерывное наличие и социально-ориентированные цены.
Как отмечают аналитики проекта PHARM GROUP компании UBI Consulting, в большинстве стран регулирование сферы фармацевтики осуществляются уполномоченными Государственный органами в строго регламентированной форме и охватывают следующие аспекты:
-
Контроль качества, в т.ч.
- лицензирование производства лекарственных средств и фармацевтической деятельности
- государственная регистрация лекарственных препаратов
- ведение государственного реестра лекарственных средств
- мониторинг безопасности, экспертизы, клинические исследования лекарственных средств и т. д.
-
Регулирование ценообразования на лекарственные средства, в т.ч.:
- определение перечня социально-ориентированных препаратов и формирование фиксированных цен на них
- уровень наценок на оптовые и розничные цены и т.д.
Согласно данным Исполнительного комитета Межгосударственного Совета СНГ по антимонопольной политике в странах СНГ порядок осуществления государственного контроля качества лекарственных средств также основан на вышеотмеченных процедурах и регламентирован следующими национальными правовыми актами:
- в Азербайджане, Армении, Киргизии, Молдове, России и Таджикистане – законами
- в Казахстане, Беларуси - приказом Министра здравоохранения и социального развития
- в Украине - постановлением Правительства
Сводом регламентов и документов, нормирующих качество лекарственных средств в каждом государстве, является Фармакопея. Национальные формуляры в каждом из стран СНГ, с позиций применяемых методик контроля качества лекарственных средств, имеют существенные различия.
По оценкам аналитиков, наиболее приближенная к международным требованиям считается Национальная фармакопея Республики Беларусь, тогда как Россия придерживается концепции развития оригинальной Государственной фармакопеи.
В Республике Казахстан наряду с Государственной фармакопеей признается европейская и британская фармакопея, а также фармакопея США. Несмотря на то, что материалы Госфармакопеи Казахстана изложены в редакции, максимально сближающей ее с Европейской фармакопеей, они имеют принципиальные отличия, позволяющие характеризовать ее как национальную.
Как правило, в сфере оборота лекарственных средств, контроль качества продукции и ее соответствия установленным требованиям базируется на двух механизмах:
- первый − отраслевой, включающий регистрацию, лицензирование, фармакопейную программу, правила GMP;
- второй − межотраслевой, подразумевающий сертификацию или декларацию о соответствии.
При этом, режимы допуска лекарственных средств на национальные товарные рынки могут иметь различия с позиций установленной государственной политики в области национального здравоохранения и фармацевтики.
Так, в Армении сертификация и декларирование лекарственных средств не проводятся, а с 2001 года, в соответствии с постановлением Правительства Республики, внедрен механизм контроль ввозимых лекарственных средств (импорта).
В Казахстане с 2012 года лекарственные средства выведены из системы технического регулирования. Вместо подтверждения соответствия (сертификации) введена система оценки безопасности и качества лекарственных средств.
В России функционируют два способа подтверждения качества продукции: декларирование соответствия и сертификация. Выбор способа подтверждения качества лекарственных средств установлен Правительством Российской Федерации и зависит от того, в какой список попала данная продукция.
Декларация о соответствии может быть принята как на основании доказательств производителя, так и на основании доказательств, полученных при участии третьей стороны − органа по сертификации и независимой испытательной лаборатории. Срок действия декларации о соответствии устанавливается на период, не превышающий срока годности данной партии (серии) лекарственного средства.
Контроль и надзор за обращением лекарственных средств в государствах – участниках СНГ организован также по-разному.
Так, в Молдове полномочиями по регулированию и надзору в области лекарств, фармацевтической деятельности и медицинских изделий наделено Агентство по лекарствам и медицинским изделиям, которое выполняет контроль на всех стадиях обращения лекарств: осуществляет регистрацию лекарств, лицензирование производства и импорта лекарств, надзор за качеством лекарств, контроль фармацевтической деятельности, координирование процессов обеспечения лекарствами на национальном уровне, консультирование фармацевтических предприятий и т. д.
В Украине контроль за качеством лекарственных средств и условиями их производства осуществляется центральным органом исполнительной власти по лекарственным средствам – Государственной службой Украины по лекарственным средствам и подчиненными ей территориальными органами, которые осуществляют организационные и правовые меры, направленные на соблюдение субъектами хозяйственной деятельности требований законодательства относительно обеспечения качества лекарственных средств, в том числе проводят сертификацию производства лекарственных средств на соответствие требованиям надлежащей производственной практики (GMP).
В России отсутствует централизованный отраслевой регуляторный орган, существующий в большинстве зарубежных стран. Например - Агентство по медикаментам Евросоюза (EMA), Агентство по контролю продуктов для здравоохранения Великобритании (MHRA), Администрация по пищевым и лекарственным продуктам США (FDA), аналогичные структуры Франции (AFSSAPS), Италии (AIFA), Швеции (MPA), Швейцарии (Swissmedic), Канады (HealthCanada), Австралии (TGA). Создание подобного органа рекомендуется и в документах ВОЗ.
Исторически сложилось, что в России действует несколько надзоров, участвующих в охране здоровья, – это Росздравнадзор, Роспотребнадзор и Россельхознадзор. Помимо этого, в сфере обращения лекарственных препаратов для медицинского применения функцией надзора наделены еще несколько ведомств:
- Минпромторг России – осуществляет лицензирование производства лекарственных препаратов
- Росздравнадзор и субъекты Российской Федерации - осуществляет лицензирование фармацевтической деятельности
- Минздрав России – осуществляет регистрацию лекарственных средств для медицинского применения
- Россельхознадзор – осуществляет регистрацию лекарственных средств для ветеринарного применения
- Роспотребнадзор – осуществляет регистрацию БАД
- Росздравнадзор – осуществляет надзор за обращением лекарственных средств для медицинского применения
- Сертификационные центры Росздравнадзора – осуществляют посерийное декларирование соответствия производимых препаратов
Аналитики проекта PHARM GROUP компании UBI Consulting отмечают, что в Таджикистане контроль за качеством лекарственных средств и условиями их производства осуществляется центральным органом исполнительной власти по лекарственным средствам - Службой государственного надзора за фармацевтической деятельностью РТ и, созданным при этом органе, отделом по фармакологическому надзору за лекарственными средствами.
В Киргизии контроль за качеством лекарственных средств осуществляется Департаментом лекарственного обеспечения и медицинской техники Министерства здравоохранения согласно Инструкции "О порядке проведения государственного контроля качества лекарственных средств и изделий медицинского назначения" и Инструкции "О порядке проведения контрольно-аналитическими лабораториями государственного контроля качества отечественных и зарубежных лекарственных средств на территории Кыргызской Республики".
В Азербайджане органом исполнительной власти в области фармацевтической деятельности, наделенный функциями контроля качества лекарственных средств является Центр аналитической экспертизы лекарственных средств (ЦАЭЛС) Министерства здравоохранения Азербайджана. А в Армении и Белоруссии такими функциями наделены соответственно - Научный центр экспертизы лекарств и медицинских технологий (НЦ ЭЛМТ) и РУП «Центр экспертиз и испытаний в здравоохранении» Министерства здравоохранения Республики Беларусь..
Не секрет – не зависимо от степени развития страны и уровня жизни населения, социальная нагрузка на лекарственные препараты всегда была и остается высокой. И большинство стран, как правило, следуют курсу снижения финансовой нагрузки на население контролем и регулированием оптовой и розничной наценки на лекарственные средства. Необходимость регулирования цен на лекарства связана с растущими расходами граждан и общественных плательщиков на их приобретение, что особенно в условиях ограниченных ресурсов снижает доступность лекарств.
В рамках проведенного исследования со стороны Исполнительного комитета Межгосударственного Совета СНГ по антимонопольной политике было установлено, что в определенной мере цены на лекарства регулируются в большинстве государств − участников СНГ. Даже беглый анализ международного опыта свидетельствует о многообразии моделей такого регулирования. Различные механизмы регулирования цен на лекарственные средства применяются в Беларуси, Казахстане, Молдове, России, Туркменистане и Украине. Вместе с тем в таких государствах как - Армения, Кыргызстан, Таджикистан какие-либо ограничения цен на лекарства не применяются.
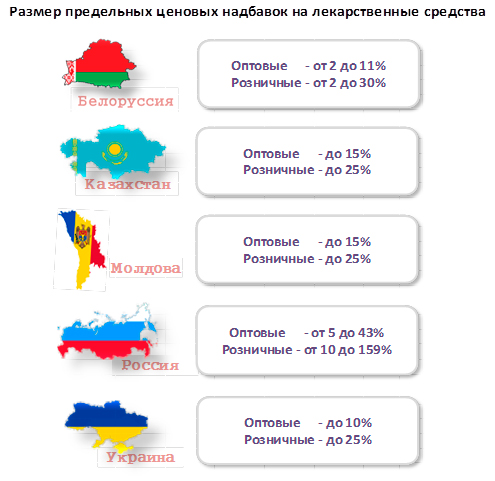
В Беларуси, Казахстане, России и Украине регулирование распространяется только на определенную часть лекарств, как правило - на возмещаемые и включенные в государственные программы лекарственного обеспечения. Лекарственные средства, не финансируемые за счет налогоплательщиков и доступные на рынке, не подпадают под правила ограничений ценообразования и их оптовая и розничная стоимость свободно определяются соотношением спроса и предложения. Но есть и такие страны, например – Молдова, где под ценовое регулирование со стороны государства подпадают все зарегистрированные в этой стране лекарства.
Особенности систем регулирования цен на лекарственные средства в странах СНГ
|
Страны СНГ |
Лекарства, подлежащие регулированию цен |
Порядок регулирования цен на лекарственные препараты |
|
Республика Беларусь |
Препараты отечественного производства (35 МНН − 99 препаратов с учетом ТН, лекарственных форм и дозировок) |
Установление Минздравом Беларуси предельных отпускных цен отечественных производителей на 35 МНН, ограничение оптовых и розничных надбавок |
|
Республика Казахстан |
Лекарства, входящие в список закупаемых в рамках гарантированного объема бесплатной медицинской помощи |
Ежегодное утверждение предельных закупочных цен на торгах, на коммерческом рынке. Заключаются меморандумы по сдерживанию роста цен на 200 лекарственных средств между Минздравом Республики Казахстан и фармацевтическими ассоциациями |
|
Республика Молдова |
Все лекарства, включенные в Государственный регистр лекарств |
Регистрация предельных отпускных цен производителей, ограничение оптовых и розничных надбавок |
|
Российская Федерация |
Лекарства, включенные в Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) |
Регистрация предельных отпускных цен производителей ЖНВЛП, ограничение оптовых и розничных надбавок |
|
Украина |
Лекарства, включенные в Национальный перечень основных лекарственных средств и в обязательный минимальный ассортимент (социально ориентированных) лекарственных средств |
Декларирование производителями и импортерами цен без права пересмотра в течение 2 лет, ограничение оптовых и розничных надбавок |
Несомненно, на цены лекарственных средств могут оказывать существенное влияние методы государственного регулирования, действующие системы лекарственного возмещения (лекарственного страхования), наличие разного перечня лекарств в обращении, разные даты выхода лекарств из-под патентной защиты, разница валютных курсов, различные объемы потребления конкретных препаратов, структура и уровень доходов и расходов населения и пр. А применяемая в внутри страны ставка НДС на лекарственные средства в этом списке стоит на первом месте.
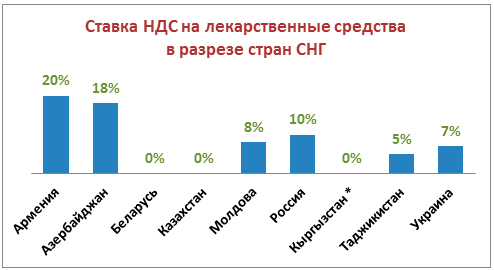
* только для определенного перечня лекарств.
Аналитики PHARM GROUP отмечают, что в современной производственной и др. коммерческой индустрии, затрагивающей напрямую здоровье нации, способы регулирования как оптовых, так и розничных цен на фармацевтических рынках стран СНГ, подвержены жесткому регламентному контролю со стороны большого количеством национальных законодательных актов, постановлений, руководств и приказов. Они нацелены на обеспечение населения, как качественными, эффективными и безопасными лекарственными средствами, так и социально-доступными ценами, что, несомненно, имеет свое отражение и на ценах импортируемых лекарственных средств. Притом, что сам процесс регистрации ЛС, ИМН и МО в странах СНГ представляется достаточно сложным, так как затрагивает множества инстанционных ступеней и характеризуется переплетениями нюансов законодательного и исполнительного характера и, соответственно, требуют определенных знаний национального колорита и практических навыков взаимодействия с официальными органами и предполагает существенные как ресурсные, так и временные затраты.
Для эффективного решения подобных вопросов производители, как правило, обращаются к услугам специализированных консалтинговых компаний, которые, традиционно, предлагают стандартный комплекс услуг, включающих:
• Консультирование по регистрации или перерегистрации
• Сбор и комплектация пакета требуемой документации
• Отчеты о процессе регистрации
На просторах пост-советского государства, на сегодняшний день, функционирует достаточное количество компаний, которые предлагают услуги по регистрации и перерегистрации лекарственных средств и медицинского оборудования, а также продуктов косметологии и ветеринарии.
Но особняком в этой компании стоит проект PHARM GROUP компании UBI Consulting, которая уже на протяжении 15 лет задает тон и высоко держит планку качества услуг. Помимо вышеупомянутых традиционных консалтинговых услуг, эксперты PHARM GROUP, обладая глубокими предметными знаниями и многолетним опытом в сфере регистрации, оказывают услуги по непосредственному представлению интересов производителей в органах государственной регистрации/сертификации, организации доклинических и клинических испытаний практически во всех странах СНГ.
Несомненным преимуществом проекта PHARM GROUP компании UBI Consulting перед другими консалтинговыми компаниями является и то, что специалисты нашей компании осуществляют процедуру регистрации действительно под ключ, предоставляя дополнительные услуги по переводу документов, подаче досье и пакета документов регулирующим органам, приемке и таможенному оформлению образцов и т. д. Соответственно можно сказать, что опираясь на глубокие теоритические знания и многолетний практический опыт специалистов PHARM GROUP, компания UBI Consulting в состоянии оказать эффективную поддержу интересам узбекских производителей фармацевтических препаратов как в регистрации их продукции в странах СНГ, так и в представлении консалтинговых услуг по национальным особенностям и нюансам фармацевтических рынков стран постсоветского пространства.
Жамшид Ганиев
Руководитель по регистрации и продвижению медицинских, фармацевтических и ветеринарных продуктов
PHARM GROUP - UBI Consulting, Узбекистан
info@ubi.uz www.pharm.ubi.uz
