Снижение риска развития сердечно-сосудистых заболеваний при раннем лечении анемии эпоэтином бета
Cardiovascular Risk Reduction by Early Anaemia Treatment with Epoetin Beta
Пациенты 1 группы немедленно начинали получать Рекормон с целью достижения уровня Hb в 13-15 г/дл к концу фазы коррекции (при индивидуальном повышении Hb не менее 2 г/дл приблизительно за 3 месяца).
Пациенты 2 группы получали Рекормон в случае, когда они достигали предельного уровня Hb < 10/5 г/дл. При этом уровень Hb должен был поддерживаться между 10,5-11,5 г/дл. Начальная доза Рекормона в обеих группах составляет 2000 ЕД, вводимых самостоятельно подкожно один раз в неделю с помощью Реко-Пен. В течение всего исследования ведется постоянный мониторинг безопасности, клинического состояния и сердечно-сосудистых показателей. Структурные и функциональные изменения в сердце определяются с помощью эхокардиографии в начале исследования, ежегодно и в начале заместительной почечной терапии. Функции почек, параметры безопасности и показатели железа документируются раз в 3 месяца. Статус упитанности и качество жизни оцениваются каждый год. Измерения гемоглобина проводится не реже 1 раза в три месяца. Больные с гипертензией в обеих группах должны получать лечение, направленное на достижение систолического артериального давления ≤150 мм рт.ст. и диастолического давления ≤90 мм рт.ст. в первые 3 месяца после рандомизации. Лекарственные средства и лечебные процедуры, связанные с почечной анемией и любыми сопутствующими заболеваниями, должны быть разрешены и задокументированы.
Проф. И.Дрюк, Франция (председатель); Проф. Н.Клайн, Швеция; Проф. К.-У.Эккардт, Германия; Проф. Ф.Локателли, Италия Проф. И.Макдугал, Соед.Кор.; Проф. Д.Изакирис, Греция; Проф. Ф.Вальдеррабано, Испания.
Совет по безопасности и мониторингу данных
Безопасность включенных в исследование больных обеспечивается независимым Советом по мониторингу безопасности данных. Совет ответственен за регулярный обзор данных, касающихся безопасности. Проф. Р.Н.Фоли, Манчестер, Соед. Кор. (Нефрология); Проф. А.Левин, Ванкувер, Канада (Нефрология); Проф. М.Пфистерер, Базель, Швейцария (Кардиология), Др. А.М.Скин, Ноттингем, Соед.Кор. (Статистика)
Комитет по подведению итогов
Проф. П.Юнгер, Франция (Нефрология); Проф. В.Киовски, Цюрих, Швейцария (Кардиология); Проф. Й.Роландт, Роттердам, Нидерланды (Кардиология).
Спонсор настоящего исследования – Ф. Хоффманн-Ля Рош Лтд.
ИССЛЕДОВАНИЕ
В открытом многоцентровом рандомизированном исследовании с параллельными группами изучался эффект раннего лечения анемии препаратом Рекормон на риск развития сердечно-сосудистых заболеваний у больных в додиализном периоде.ПРЕДПОСЫЛКИ
Анемия является сопутствующим состоянием при хронической почечной недостаточности (ХПН), независимо от потребности в диализе. Патогенез анемии при ХПН является многофакторным, при этом дефицит эритропоэтина считается основным патологическим фактором. Общепринятым методом лечения почечной анемии является заместительная терапия эпоэтином бета. Сердечно-сосудистые заболевания являются причиной до 50% смертности диализных больных, причем смертность от сердечно-сосудистых болезней при ХПН в 5-10 раз превышает смертность в общей популяции. Доказано, что в этом контексте гипертрофия левого желудочка (ГЛЖ) является независимым фактором риска внезапной смерти, желудочковых аритмий, ишемии миокарда и развития сердечной недостаточности. Как оказалось, анемия играет ключевую роль в индуцировании развития сердечных повреждений: доказано, что снижение уровня гемоглобина (Hb) является независимым показателем увеличения левого желудочка, который в конечном итоге, совместно с гипертензией, часто ему сопутствующей, несмотря на гипотензивное лечение, ведет к ГЛЖ и росту смертности среди больных с ХПН. Несколько исследований меньшего масштаба показывает, что лечение рекомбинантным человеческим эритропоэтином (рчЭПО, эпоэтин) может вызвать регресс ГЛЖ и даже предотвращать ее развитие.ЦЕЛИ ИССЛЕДОВАНИЯ
Исследование CREATE изучает влияние ранней коррекции анемии с помощью препарата Рекормон (эпоэтин бета) на риск развития сердечно-сосудистых заболеваний у больных с хронической почечной анемией, еще не получающих заместительную терапию. В исследовании CREATE рассматривается безопасность, эффективность и клинические преимущества коррекции анемии препаратом Рекормон путем сравнения раннего и позднего лечения анемии у этих больных. Влияние этих двух вариантов лечения на риск развития сердечно-сосудистых заболеваний будет оценивается на основе комбинированной первичной конечной точки – сердечно-сосудистой заболеваемости. Несколько вторичных конечных точек состоят во влиянии лечения анемии на прогрессирование почечной недостаточности, ГЛЖ и качество жизни в двух группах исследования.ИССЛЕДУЕМАЯ ПОПУЛЯЦИЯ
Исследование CREATE было начато в августе 2000 года. Набор в группы уже завершен; отобрано > 600 больных с умеренной анемией (11,0-12,5 г/дл Hb) и ХПН, еще не требующим заместительной терапии.
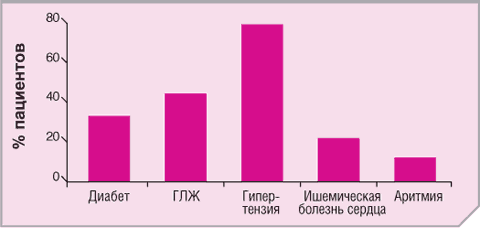
Рис.1. Распространенность факторов риска сердечно-сосудистых заболеваний среди больных с ХПН (из работы Вальдеррабано Ф. и др., Nephrol Dial Transplant 2001)

ПЛАН ИССЛЕДОВАНИЯ
CREATE – открытое с параллельными группами исследование продолжительностью до 5 лет. Международное многоцентровое исследование проводится во множестве центров – > 100 центров из более 20 стран-участниц. Цель исследования – сравнить воздействие ранней коррекции анемии до уровня гемоглобина (Hb) в 13-15 г/дл и поздней коррекции анемии до уровней Hb в 10,5-11,5 г/дл. Для достижения целей исследования половина больных, участвующих в исследовании (см. следующую страницу), была рандомизирована в группу, в которой уровень гемоглобина должен был достичь 13-15 г/дл (1 группа) и группу, целью лечения в которой было поддержание уровня Hb в 10,5-11,5 г/дл (2 группа).КОНЕЧНЫЕ ТОЧКИ ИССЛЕДОВАНИЯ
Первичные конечные точки- Комбинированная конечная точка для сердечно-сосудистой заболеваемости (время до первого события) определяется как стенокардия, ведущая к госпитализации не менее, чем на 24 часа или длительной госпитализации, острая сердечная недостаточность, инфаркт миокарда со смертельным исходом или без него, инсульт со смертельным исходом или без него, внезапная смерть, транзиторная ишемическая атака (ТИА), заболевание периферических сосудов или сердечные аритмии, ведущие к госпитализации.
- Смертность от сердечно-сосудистых болезней.
- Смертность от всех причин.
- Хроническая сердечная недостаточность (классификация NYHA).
- Сердечно-сосудистые операции.
- Госпитализации и продолжительность госпитализаций, связанных с сердечно-сосудистой системой.
- Индекс массы левого желудочка.
- Объемы левого желудочка.
- Качество жизни (анкета SF-36).
Другие переменные
- Прогрессирование почечной недостаточности, определяемое по клиренсу креатинина, времени начала заместительной почечной терапии, упитанности (индекс массы тела, сывороточный альбумин, СРБ), уровни гемоглобина, недельная доза эпоэтина бета, время и тип диализа, необходимость в гемотрансфузиях.
ОСНОВНЫЕ КРИТЕРИИ ВКЛЮЧЕНИЯ
- Взрослые (≥18 лет) с хронической почечной анемией, не получающие заместительную терапию.
- Hb 11,0-12,5 г/дл во время скрининга.
- Клиренс креатинина 15-35 мл/мин (Кокрофт-Голт) во время скрининга.
- Не менее одного определения сывороточного креатинина за 4-12 месяцев до включения в группу и одно определение за 1-3 месяца до включения (кроме определения во время скрининга).
- Артериальное давление: систолическое ≤170 мм рт. ст., диастолическое ≤95 мм рт. ст.
ОСНОВНЫЕ КРИТЕРИИ ИСКЛЮЧЕНИЯ
- Быстрое прогрессирование ХПН (увеличение сывороточного креатинина более чем на 20% за 3 месяца).
- Предположительно возникновение необходимости в проведении диализа в последующие 6 месяцев лечения.
- Выраженные изменения со стороны клапанов сердца.
- Хроническая сердечная недостаточность, класс III-IV по NYHA.
- Инфаркт миокарда, нестабильная стенокардия или инсульт в последние 3 месяца.
- Гемолиз.
- Дефицит витамина В12 или фолиевой кислоты, установленный как средний корпускулярный объем > 105 fl.
- Количество тромбоцитов > 500000/мкл.
- Сывороточный ферритин < 50 нг/мл.
- Гемотрансфузии в последние 3 месяца.
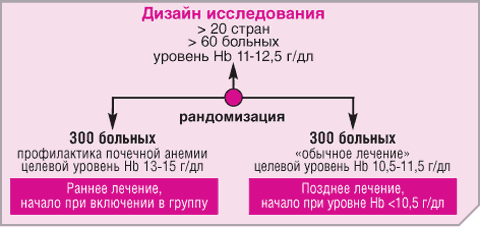
Рис. 2. Дизайн исследования CREATE

МЕТОДОЛОГИЯ
Додиализные больные, соответствующие критериям включения/исключения, были рандомизированы на две одинаковые группы (по 300 больных в каждой группе) с двумя различными целевыми уровнями достижения Hb. Пациенты 1 группы немедленно начинали получать Рекормон с целью достижения уровня Hb в 13-15 г/дл к концу фазы коррекции (при индивидуальном повышении Hb не менее 2 г/дл приблизительно за 3 месяца).
Пациенты 2 группы получали Рекормон в случае, когда они достигали предельного уровня Hb < 10/5 г/дл. При этом уровень Hb должен был поддерживаться между 10,5-11,5 г/дл. Начальная доза Рекормона в обеих группах составляет 2000 ЕД, вводимых самостоятельно подкожно один раз в неделю с помощью Реко-Пен. В течение всего исследования ведется постоянный мониторинг безопасности, клинического состояния и сердечно-сосудистых показателей. Структурные и функциональные изменения в сердце определяются с помощью эхокардиографии в начале исследования, ежегодно и в начале заместительной почечной терапии. Функции почек, параметры безопасности и показатели железа документируются раз в 3 месяца. Статус упитанности и качество жизни оцениваются каждый год. Измерения гемоглобина проводится не реже 1 раза в три месяца. Больные с гипертензией в обеих группах должны получать лечение, направленное на достижение систолического артериального давления ≤150 мм рт.ст. и диастолического давления ≤90 мм рт.ст. в первые 3 месяца после рандомизации. Лекарственные средства и лечебные процедуры, связанные с почечной анемией и любыми сопутствующими заболеваниями, должны быть разрешены и задокументированы.
СТАТИСТИКА
Первичная конечная точка (комбинированная сердечно- сосудистая патология) будет анализироваться согласно методике, пригодной для данного случая. Всего для выявления значимого снижения (р < 0,05), охватывающего 80% по первичной конечной точке, понадобится 200 случаев. При размере выборки в 600 больных исследование CREATE займет примерно 2 года, или срок, необходимый для наблюдения всех 200 случаев сердечно-сосудистой патологии. Поэтому продолжительность исследования не фиксирована и зависит от того, сколько случаев наблюдается в исследуемой популяции.Клиническое значение
- CREATE является первым перспективным крупномасштабным исследованием влияния раннего лечения Рекормоном больных с анемией и ХПН, не требующей заместительной почечной терапии.
- CREATE прояснит ключевые вопросы стратегии раннего лечения анемии у этих больных:
- снизит ли раннее лечение сердечно-сосудистую заболеваемость?
- способствует ли раннее лечение уменьшению смертности?
- снизит ли раннее лечение ГЛЖ?
- принесет ли раннее лечение улучшение качества жизни?
- принесет ли раннее лечение другую пользу, т.е. отсрочку начала диализа благодаря предупреждению прогессирования болезни почек?
- CREATE даст возможность получить новые важные данные относительно потенциального преимущества ранней коррекции анемии с помощью Рекормона, предотвращающего риск развития сердечно-сосудистых заболеваний и снижения сердечно-сосудистой заболеваемости.
Организация исследования
Научная комиссия по выработке регламента Проф. И.Дрюк, Франция (председатель); Проф. Н.Клайн, Швеция; Проф. К.-У.Эккардт, Германия; Проф. Ф.Локателли, Италия Проф. И.Макдугал, Соед.Кор.; Проф. Д.Изакирис, Греция; Проф. Ф.Вальдеррабано, Испания.
Совет по безопасности и мониторингу данных
Безопасность включенных в исследование больных обеспечивается независимым Советом по мониторингу безопасности данных. Совет ответственен за регулярный обзор данных, касающихся безопасности. Проф. Р.Н.Фоли, Манчестер, Соед. Кор. (Нефрология); Проф. А.Левин, Ванкувер, Канада (Нефрология); Проф. М.Пфистерер, Базель, Швейцария (Кардиология), Др. А.М.Скин, Ноттингем, Соед.Кор. (Статистика)
Комитет по подведению итогов
Проф. П.Юнгер, Франция (Нефрология); Проф. В.Киовски, Цюрих, Швейцария (Кардиология); Проф. Й.Роландт, Роттердам, Нидерланды (Кардиология).
Спонсор настоящего исследования – Ф. Хоффманн-Ля Рош Лтд.
ССЫЛКИ
- Adamson JW, Eschbach JW. Erythropoietin for end stage renal disease. NEJM 1998; 339: 625 627.
- Bailie GR, Low CL. Eisele G. Erythropoietin effectiveness index. A quantative definition of resistance in haemodialysis patients with adequate iron stores. Clin Drug Invest 1998 Jan; 15: 57 60.
- Bajo MA, Selgas R. Castro MJ, Jimenez C, Fernandez Reyes MJ. Del Peso G, De Alvaro F, Sanchez Sicilia AL. Erythropoietin treatment decreases cardiovascular morbidity and mortality in CAPD patients. Pent Dial hit 1997; 17: 129 135.
- European Best Practice Guidelines for the management of Anemia in Patients with Chronic Renal Failure. Ncphroi Dial Transplant 1999: 14 Suppl 5: 1-50. Hayashi T, Suzuki A, Shoji T et al. Cardiovascular effect of normalizing the hematocrit level during erythropoietin therapy in predialysis patients with chronic renal failure. Am J Kidney Dis 2000; 35: 250 256
- Macdougall IC. Meeting the challenges of a new millennium: optimizing the use of recombinant human erythropoietin. Nepkroi Dial Transplant 1998; 13: 23-27.
- Portoles I, Torralbo A, Martin P, Rodrigo J, Herrero JA, Barrientos A. Cardiovascular effects of recombinant human erythropoietin in predialysis patients. Am J Kidney Dis 1997; 29: 541-548
- Raine AE, Margreiter R, Brunner FP, Ehrich JH, Geerlings W, Landais P. Loirat C, Mallick NR Sehvood NH, Tufveson G, el al. Report on management of renal failure in Europe, XXII 1991. Nephroi Dial Transplant 1992; 7 Suppl 2: 735.
Valderrabano F, on behalf of the Spanish group for the study of the anaemia and left ventricular hypertrophy in predialysis patients. Improvement and prevention of left ventricular hypertrophy in predialysis patiems [abstract]. J Am Soc Nephrol 2000; 11: A0424
Оставить отзыв
