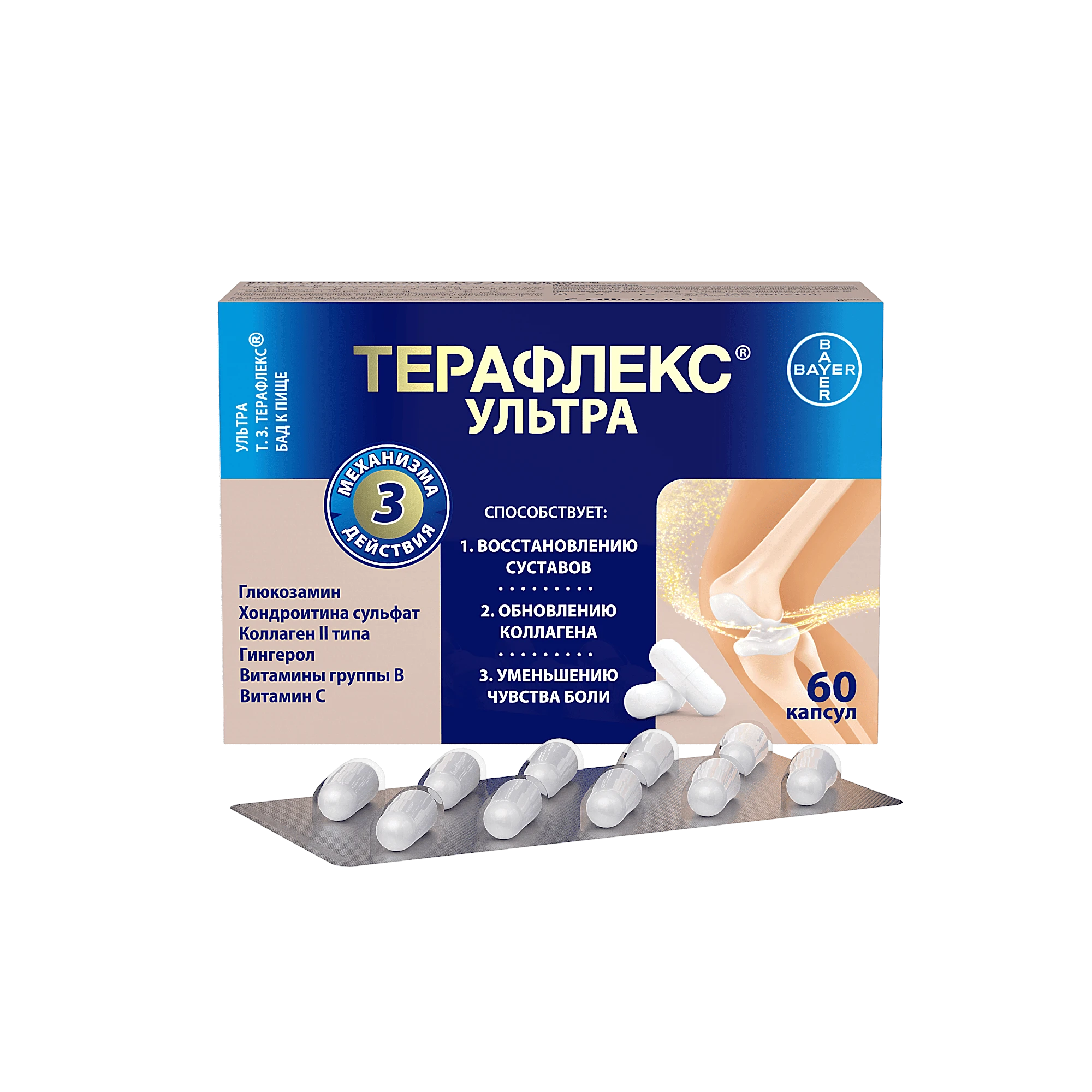
ЗОЛЕОСТ концентрат 5 мл 4 мг/5 мл N1

Ингибитор костной резорбции
Инструкция ЗОЛЕОСТ концентрат 5 мл 4 мг/5 мл N1
Хранение
Хранить при температуре не выше 25 °С.
Условия хранения
Хранить при температуре не выше 25 °С.
Состав и форма выпуска
Состав:
один флакон (5мл) содержит:
активное вещество: золедроновая кислота 4 мг (в виде моногидрата 4,264 мг);
вспомогательные вещества: маннитол, натрия цитрата дигидрат, вода для инъекций, гидроксид натрия (в виде 10% раствора), соляная кислота (в виде 10% раствора).
Фармакодинамика
Золедроновая кислота относится к новому классу бисфосфонатов, обладающих избирательным действием на кость, и является ингибитором резорбции костной ткани.
Избирательное действие бисфосфонатов на кость связано с их высоким сродством к минерализованной кости, однако точный молекулярный механизм, обеспечивающий ингибирование активности остеокластов, до сих пор остается невыясненным. Золедроновая кислота ингибирует резорбцию кости, не оказывая при этом нежелательного воздействия на формирование, минерализацию и механические свойства кости.
Кроме ингибирования остеокластической костной резорбции, золедроновая кислота оказывает непосредственное противоопухолевое действие на культивированные клетки миеломы и рака молочной железы человека, которое заключается в подавлении пролиферации и индукции апоптоза опухолевых клеток.
У пациентов с гиперкальциемией, вызванной опухолью, действие золедроновой кислоты характеризуется снижением концентрации кальция в сыворотке и уменьшением его выведения с мочой.
Фармакокинетика
Значения фармакокинетических показателей золедроновой кислоты не зависят от дозы. Золедроновая кислота in vitro не ингибирует фермент Р450 и не подвергается биотрансформации. Золедроновая кислота выделяется в неизмененном виде через почки. Состояние функции печени существенно не влияет на фармакокинетику золедроновой кислоты.
После начала инфузии золедроновой кислоты концентрации препарата в плазме быстро возрастают, достигая пика к концу инфузионного периода, после чего происходит быстрое уменьшение концентрации до <10% пика через 4 часа и <1% пика через 24 часа с последующим длительным периодом очень низких концентраций, не превышающих 0,1% пика, до второй инфузии препарата на 28-й день.
Распределение
Золедроновая кислота имеет низкое сродство с клеточными компонентами крови, среднее соотношение концентрации в крови и плазме составляет 0,59 в диапазоне концентраций от 30 нг/мл до 5000 нг/мл. Связывание с белками плазмы низкое, несвязанная фракция варьирует от 60% при 2 нг/мл до 77% при 2000 нг/мл золедроновой кислоты.
Золедроновая кислота, введенная внутривенно, выводится почками в три этапа: быстрое двухфазное выведение препарата из системной циркуляции с периодами полувыведения 0,24 ч и 1,87 ч и длительная фаза с конечным периодом полувыведения, составляющим 146 ч. Золедроновая кислота не подвергается метаболизму и выводится почками в неизмененном виде.
В течение первых 24 часов в моче обнаруживается 39±16% введенной дозы. Остальное количество препарата в основном связывается с костной тканью. Затем медленно происходит обратное высвобождение золедроновой кислоты из костной ткани в системную циркуляцию и ее выведение почками.
Общий плазменный клиренс препарата составляет 5,04±2,5 л/ч. Он не зависит от дозы препарата, пола, возраста, расовой принадлежности и массы тела пациента. Увеличение продолжительности инфузии с 5-ти минут до 15-ти минут приводит к снижению на 30% концентрации золедроновой кислоты в крови в конце инфузии, но никак не влияет на величину площади под кривой «концентрация-время» (AUC).
Почечный клиренс золедроновой кислоты прямо связан с клиренсом креатинина. Почечный клиренс золедроновой кислоты 75±33 % от клиренса креатинина составлял в среднем 84±29 мл/мин (диапазон от 22 до 143 мл/мин). У больных с клиренсом креатинина от 20 мл/мин (тяжелая почечная недостаточность) до 50 мл/мин (умеренная почечная недостаточность), относительный клиренс золедроновой кислоты будет 37 % или 72 % соответственно, по сравнению с клиренсом креатинина пациента 84 мл/мин.
Данные по фармакокинетике у пациентов с острой почечной недостаточностью (клиренс креатинина <30 мл/мин) ограничены. Не рекомендуется применять препарат Золеост у пациентов с острой почечной недостаточностью.
Фармакотерапевтическая группа
Ингибитор костной резорбции
Фармакотерапевтическое действие
Препараты для лечения заболеваний костно - мышечной системы. Препараты для лечения заболеваний костей. Препараты, влияющие на структуру и минерализацию костей. Бисфосфонаты.
Лекарственная форма
По 5 мл препарата помещают во флаконы из прозрачного стекла типа I, укупоренные пробками из бромбутилкаучука и обкатанные колпачками. Резиновый материал покрыт слоем фторполимера. Флакон вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Побочные действия
Очень часто (≥1/10)
- гипофосфатемия;
Часто (≥1/100 <1/10)
- анемия;
- головная боль;
- конъюнктивит;
- тошнота, рвота, снижение аппетита;
- гипергидроз;
- боль в костях, миалгия, артралгия, генерализованная боль в теле;
- почечная недостаточность;
- лихорадка, гриппоподобные заболевания (включая усталость, озноб, недомогание и приливы);
- повышенные уровни в крови креатинина и мочевины, гипокальциемия;
Нечасто (≥1/1,000 <1/100)
- тромбоцитопения, лейкопения;
- реакция гиперчувствительности;
- беспокойство, нарушения сна;
- головокружение, парестезия, нарушение вкусовых ощущений, гипостезия, гиперестезия, тремор, сонливость;
- нечеткость зрения, склерит и воспаление орбиты;
- гипертензия, гипотензия, фибрилляция предсердий, гипотензия, приводящая к обмороку или коллапсу кровообращения;
- диспноэ, кашель, бронхоспазм;
- диарея, запор, абдоминальная боль, диспепсия, стоматит, сухость во рту;
- зуд, высыпание (включая эритематозное и макулярное высыпание), повышенная потливость;
- мышечные спазмы, остеонекроз челюсти;
- острая почечная недостаточность, гематурия, протеинурия;
- астения, периферический отек, реакции в месте инъекции (включая боль, раздражение, вздутие, уплотнение), боль в груди, увеличение массы тела, анафилактическая реакция/шок, крапивница;
- гипомагниемия, гипокалиемия;
Редко (≥1/10,000 <1/1,000)
- панцитопения;
- ангионевротический отек;
- спутанность сознания;
- увеит;
- интерстициальная болезнь легких;
- брадикардия, сердечная аритмия (на фоне гипокальциемии);
- интерстициальная болезнь легких;
- приобретенный синдром Фанкони;
- артрит и опухание суставов (как симптом острофазовой реакции);
- гиперкалиемия, гипернатриемия;
Очень редко (<1/10,000)
- судороги, гипестезия и тетания (на фоне гипокальциемии);
- эписклерит;
- остеонекроз наружного слухового прохода (побочная реакция класса бисфосфонатов).
Описание отдельных нежелательных реакций
Нарушение функции почек
Применение препарата Золеост ассоциировалось с развитием нарушения функции почек. При применении препарата в клинических исследованиях с целью профилактики осложнений со стороны скелета у пациентов с распространенными злокачественными новообразованиями с поражением костей частота возникновения нарушения функции почек, связанного с применением препарата, распределена следующим образом: множественная миелома (3,2%), рак простаты (3,1%), рак молочной железы (4,3%), рак легких и другие солидные опухоли (3,2%). К факторам, которые могут увеличивать риск ухудшения функции почек, относятся: дегидратация, предшествующее нарушение функции почек, множественные курсы лечения препаратом Золеост или другими бисфосфонатами, одновременное применение нефротоксичных препаратов или введение препарата в течение меньшего, чем рекомендуемый, периода времени. Отмечено ухудшение функции почек, прогрессирование нарушения функции почек вплоть до почечной недостаточности и необходимости в проведении гемодиализа после введения стартовой или однократной дозы препарата Золеост.
Остеонекроз
При лечении бисфосфонатами, в том числе препаратом Золеост, в основном у пациентов с онкологическими заболеваниями отмечались случаи развития остеонекроза (в основном, челюсти, но также и другой локализации, в т.ч. тазовой кости, бедренной кости и наружного слухового канала). У многих пациентов с остеонекрозом челюсти отмечались признаки местного инфекционного процесса, в т.ч. остеомиелит; в большинстве своем таковые случаи отмечены у пациентов с онкологическими заболеваниями после экстракции зуба или после стоматологических оперативных вмешательств. Существуют широко известные множественные факторы риска, предрасполагающие к развитию остеонекроза челюсти, такие как злокачественные новообразования, одновременная терапия (например, химиотерапия, антиангиогенные препараты, лучевая терапия, глюкокортикостероиды) и сопутствующие состояния (например, анемия, коагулопатии, инфекции, предшествующее заболевание полости рта). Несмотря на то, что причинно-следственная связь не установлена, целесообразно избегать стоматологических оперативных вмешательств в связи с возможностью отсроченного выздоровления. Исходя из доступных данных, частота развития остеонекроза челюсти связна с характером опухоли (распространенный рак молочной железы, множественная миелома).
Реакция острой фазы
Данная нежелательная реакция представляет собой комплекс симптомов: повышение температуры тела, общая слабость, боль в костях, озноб, гриппоподобный синдром. Обычно начинается в интервале ≤3 дня после инфузии препарата Золеост. Реакция также упоминается с использованием терминов «гриппоподобные» или «постдозовые» симптомы. Симптомы обычно разрешаются через несколько дней.
Фибрилляция предсердий
В одном из клинических исследований при применении золедроновой кислоты в течение 3 лет у пациенток с постменопаузальным остеопорозом (в дозе 5 мг один раз в год) общая частота развития фибрилляции предсердий составляла 2,5 % (96 человек из 3862) по сравнению с 1,9% (75 из 3852) в группе плацебо. Частота развития фибрилляции предсердий, сопровождающихся тяжелыми гемодинамическими нарушениями, составляла 1,3% (51 из 3862) и 0,6% (22 из 3852) для золедроновой кислоты и плацебо соответственно. Подобный дисбаланс не отмечался в других клинических исследованиях золедроновой кислоты, в том числе при применении препарата Золеост в дозе 4 мг один раз в 3-4 недели у пациентов с онкологическими заболеваниями. Причина повышения частоты развития фибрилляций предсердий на фоне терапии золедроновой кислотой у пациенток с постменопаузальным остеопорозом в данном исследовании не установлена.
Нежелательные явления, связанные с гипокальциемией
Гипокальциемия - важный идентифицированный риск при применении препарата Золеост по одобренным показаниям. Основываясь на обзоре как клинических, так и постмаркетинговых случаев, имеется достаточное количество данных, подтверждающих связь между терапией препаратом Золеост, сообщенным событием гипокальциемии и вторичным развитием сердечной аритмии. Кроме того, имеются данные о связи между гипокальциемией и вторичными неврологическими явлениями, включая судороги, гипоастезию и тетанию.
Особые указания
Перед введением препарата Золеост следует убедиться в достаточной гидратации пациентов, включая пациентов с легким и умеренным нарушением функции почек. Следует избегать чрезмерной гидратации у пациентов с риском развития сердечной недостаточности.
Стандартные метаболические параметры, связанные с гиперкальциемией, такие как уровни кальция в сыворотке крови с коррекцией по уровню альбумина, фосфата и магния, а также креатинина в сыворотке должны быть тщательно проверены после начала терапии препаратом Золеост. При гипокальциемии, гипофосфатемии или гипомагниемии, может быть необходима кратковременная дополнительная терапия. Пациенты с гиперкальциемией, которые не получали лечение, имеют некоторую степень нарушения функции почек, поэтому необходим тщательный мониторинг показателей функции почек.
Пациенты, получающие терапию препаратом Золеост, также не должны применять другие бисфосфонаты одновременно. Безопасность и эффективность применения препарата Золеост у взрослых пациентов с тяжелой формой незавершённого остеогенеза не установлены.
Пациенты с гиперкальциемией, обусловленной злокачественной опухолью, и признаками ухудшения функции почек должны быть тщательно обследованы до оценки врачом потенциальной пользы от лечения над возможным риском.
При принятии решения о терапии пациентов с метастазами в кости для предотвращения симптомов, связанных с поражением костной ткани, следует учитывать, что начало эффекта от лечения наступает через 2-3 месяца.
Имели место сообщения об ухудшении почечной функции при применении бисфосфонатов. Факторы, увеличивающие возможность нарушения почечной функции, включают дегидратацию, ранее существующее нарушение функции почек, многократные циклы препарата Золеост или других бисфосфонатов, а также применение нефротоксичных средств или проведение инфузии в более короткое время, чем в настоящее время рекомендуется. Хотя при введении препарата Золеост в дозе 4 мг в течение не менее 15 минут риск уменьшается, ухудшение функции почек возможно. Сообщалось об ухудшении почечной функции, прогрессировании до почечной недостаточности и диализа у пациентов после введения начальной или однократной дозы препарата Золеост. Повышение уровня креатинина в сыворотке наблюдается также у некоторых пациентов, постоянно принимающих препарат в рекомендованных дозах для предотвращения возникновения симптомов, связанных с поражением костной ткани, хотя это происходит довольно редко.
Перед введением каждой дозы препарата Золеост необходимо оценивать у пациентов уровни креатинина в сыворотке крови. После начала лечения пациентам с незначительным или умеренным нарушением функции почек, за исключением пациентов с гиперкальциемией, обусловленной злокачественной опухолью, рекомендуются более низкие дозы препарата Золеост. У пациентов с признаками ухудшения почечной функции во время лечения, прием препарата можно возобновлять только тогда, когда уровень креатинина вернется к значению в пределах 10 % от исходной величины.
Не рекомендуется применение препарата Золеост у пациентов с тяжелыми нарушениями функции почек (в клинических исследованиях соответствовало уровню креатинина в сыворотке ≥ 400 мкмоль/л или ≥ 4,5 мг/дл для пациентов с гиперкальциемией, обусловленной злокачественной опухолью, и креатинину сыворотки ≥ 265 мкмоль/л или ≥ 3 мг/дл для остальных пациентов соответственно; в фармакокинетических исследованиях соответствовало клиренсу креатинина < 30 мл/мин) из-за потенциального воздействия бисфосфонатов, включая препарат Золеост, на почечную функцию, отсутствия обширных клинических данных по безопасности и фармакокинетических данных.
Отсутствуют определенные рекомендации для пациентов с тяжелой печеночной недостаточностью, поскольку доступны лишь ограниченные клинические данные.
Остеонекроз
Остеонекроз челюсти
Об остеонекрозе челюсти преимущественно сообщалось у онкологических пациентов, лечение которых включало бисфосфонаты, в том числе препарат Золеост.
Начало лечения или новый курс лечения следует отложить у пациентов с незажившими открытыми поражениями мягких тканей во рту, за исключением чрезвычайных медицинских ситуаций. Перед лечением бисфосфонатами у пациентов с сопутствующими факторами риска рекомендуется провести стоматологическое обследование с соответствующей профилактикой и индивидуальной оценкой соотношения польза/риск.
Следующие факторы риска следует учитывать при оценке риска развития остеонекроза челюсти:
- эффективность бисфосфоната (более высокий риск для сильнодействующих соединений), способ введения (более высокий риск для парентерального введения) и кумулятивная доза бисфосфоната;
- рак, сопутствующие заболевания (например, анемия, коагулопатии, инфекция), курение;
- сопутствующая терапия: химиотерапия, ингибиторы ангиогенеза, лучевая терапия шеи и головы, кортикостероиды;
- заболевания зубов в анамнезе, плохая гигиена полости рта, заболевания парадонта, инвазивные стоматологические процедуры (например, удаление зубов) и плохо подогнанные протезы.
Пациенты должны поддерживать гигиену полости рта и пройти осмотр полости рта с соответствующей профилактической санацией до начала терапии бисфосфонатами.
Во время лечения эти пациенты должны, по возможности, избегать инвазивных стоматологических процедур. У пациентов, у которых во время терапии бисфосфонатами развился остеонекроз челюсти, стоматологическая операция может ухудшить состояние. Отсутствуют данные относительно пациентов, нуждающихся в стоматологических процедурах, чтобы предположить, снижает риск развития остеонекроза челюсти прекращение лечения бисфосфонатами или нет. Врач, давая клиническую оценку, должен руководствоваться планом ведения каждого пациента, основанным на индивидуальной оценке пользы и риска.
Остеонекроз иной локализации
Остеонекроз наружного слухового прохода был зарегистрирован при применении бисфосфонатов, главным образом при длительной терапии. Возможные факторы риска развития остеонекроза наружного слухового прохода включают использование стероидов и химиотерапию и / или местные факторы риска, такие как инфекция или травма. Возможность развития остеонекроза наружного слухового прохода следует учитывать у пациентов, получающих бисфосфонаты, которые имеют симптомы, включая хронические инфекции слухового прохода.
Атипичные переломы бедренной кости
При терапии бисфосфонатами сообщалось о случаях атипичных подвертельных переломов и переломов диафиза бедренной кости, преимущественно у пациентов, получавших длительную терапию при остеопорозе. Поперечные или короткие косые переломы могут возникнуть в любом участке бедренной кости, начиная с точки непосредственно ниже малого вертела и заканчивая точкой непосредственно выше надмыщелкового расширения. Эти переломы могут возникать в результате минимального травматического воздействия или без него, и у некоторых пациентов еще за несколько недель или месяцев до развития полного перелома бедренной кости может возникать чувство боли в области тазобедренного сустава или в паховой области. Переломы обычно являются двусторонними; поэтому у пациентов, получающих терапию препаратом Золеост и у которых возник перелом диафиза бедренной кости, необходимо проводить оценку также бедренной кости второй конечности. Также сообщалось, что такие переломы плохо срастаются. У пациентов с подозрением на атипичный перелом бедренной кости, ориентируясь на индивидуальную оценку риска и пользы, следует рассмотреть возможность прекращения терапии препаратом Золеост. Сообщалось об атипичных переломах бедра у пациентов, получавших препарат Золеост, однако причинно-следственная связь с применением препарата Золеост установлена не была.
Пациентам необходимо рекомендовать сообщать о любых болях в бедре, тазобедренном суставе или паху во время терапии препаратом. Пациентов с такими симптомами следует обследовать на наличие неполного перелома бедренной кости.
Мышечная боль
В постмаркетинговых исследованиях сообщалось о тяжелой, иногда инвалидизирующий боли в костях, суставах и/или мышечной боли у пациентов, которые принимали препарат Золеост. Время до начала симптомов варьировало от одного дня до нескольких месяцев от начала лечения. У большинства пациентов после прекращения лечения происходило уменьшение выраженности симптомов. У данной категории пациентов отмечали рецидив симптомов, если лечение возобновляли тем же лекарственным средством или другим бисфосфонатом.
Гипокальциемия
Имеются сообщения о гипокальциемии у пациентов, получавших препарат Золеост. Сообщалось о вторичных по отношению к тяжелой гипокальциемии сердечных аритмиях и неврологических побочных реакциях (судороги, тетания, гипостезия). В некоторых случаях гипокальциемия может представлять угрозу для жизни.
Рекомендуется соблюдать осторожность при назначении препарата Золеост с другими препаратами, вызывающими гипокальциемию, т.к. возможен синергический эффект, приводящий к тяжелой гипокальциемии (см. раздел «Лекарственные взаимодействия»). Перед началом применения препарата Золеост следует определить уровень кальция в сыворотке крови и скорректировать гипокальциемию. Пациентам следует принимать адекватные дозы препаратов кальция и витамина D.
Влияние на способность управлять автомобилем и сложными механизмами
Нежелательные реакции, такие как головокружение и сонливость могут влиять на способность управлять автотранспортом и использовать механизмы, таким образом, следует соблюдать осторожность при применении препарата Золеост при вождении и управлении техникой.
Показания
- профилактика симптомов, связанных с патологией костной ткани (патологические переломы, компрессия позвоночного столба, осложнения после хирургических вмешательств на костях и лучевой терапии, опухоль-индуцированная гиперкальциемия), у пациентов со злокачественными новообразованиями, сопровождающимися метастазами в кости;
- гиперкальциемия, вызванная злокачественной опухолью.
Противопоказания
- повышенная чувствительность к золедроновой кислоте, другим бисфосфонатам или любым другим компонентам, входящим в состав препарата;
- период кормления грудью.
Лекарственное взаимодействие
В клинических исследованиях препарат Золеост применялся параллельно с противоопухолевыми препаратами, диуретиками (за исключением петлевых диуретиков), антибиотиками и анальгетиками. Не было выявлено клинически значимых взаимодействий препарата. Рекомендуется соблюдать осторожность при применении бисфосфонатов, таких как препарат Золеост, параллельно с аминогликозидами, кальцитонином или петлевыми диуретиками, поскольку одновременное применение препаратов может приводить к более длительному, чем необходимо, снижению уровня кальция в сыворотке. Следует соблюдать осторожность при назначении препарата Золеост и других потенциально нефротоксичных препаратов.
Необходимо обращать внимание на возможность развития гипомагниемии во время лечения. Следует соблюдать осторожность при назначении препарата Золеост и антиангиогенных препаратов, т.к. при одновременном применении этих препаратов у пациентов наблюдалось увеличение частоты остеонекроза челюсти.
у пациентов с множественной миеломой при совместном применении препарата Золеост с талидомидом может увеличиться риск почечной дисфункции.
Описание
Прозрачный бесцветный раствор.
Дозировка
Лечение препаратом Золеост должно назначаться врачом, имеющим опыт применения внутривенных бисфосфонатов.
Лечение гиперкальциемии, связанной со злокачественной опухолью
Взрослые и пациенты пожилого возраста
При гиперкальциемии (концентрация кальция с коррекцией по уровню альбумина ≥ 12 мг/дл или 3 ммоль/л) рекомендуемая доза препарата составляет 4 мг.
До введения препарата Золеост следует оценить степень гидратации пациента. Инфузию проводят при условии адекватной гидратации пациента.
Дозы
Профилактика симптомов (осложнений) со стороны костной ткани у пациентов с костными метастазами распространенных злокачественных опухолей
Взрослые и пациенты пожилого возраста
Рекомендуемая доза для профилактики (симптомов) осложнений со стороны костной ткани у пациентов с костными метастазами распространенных злокачественных опухолей составляет 4 мг препарата Золеост каждые 3-4 недели.
Пациентам также следует вводить препараты кальция внутрь в дозе 500 мг и 400 МЕ витамина Д.
При лечении пациентов с метастазами в кости для профилактики симптомов, связанных с патологией костной ткани, необходимо учитывать, что лечебный эффект может наступить через 2-3 месяца.
Лечение пациентов с гиперкальциемией, вызванной злокачественной опухолью
(ГОГ)
Взрослые и пациенты пожилого возраста
Рекомендуемая доза при гиперкальциемии (концентрация кальция в сыворотке крови с коррекцией по уровню альбумина >12,0 мг/дл или 3,0 ммоль/л) составляет однократную дозу 4 мг золедроновой кислоты.
Применение у пациентов с нарушением функции почек
Почечная недостаточность при гиперкальциемии, вызванной злокачественной опухолью
Лечение препаратом Золеост гиперкальциемии, вызванной злокачественной опухолью, у пациентов с выраженной почечной недостаточностью следует назначать только после оценки риска и пользы данного лечения. В клинических исследованиях пациенты с уровнем креатинина в сыворотке крови > 400 мкмоль/л или > 4,5 мг/дл были исключены. Нет необходимости в коррекции дозы у пациентов с гиперкальциемией, вызванной злокачественной опухолью, у которых уровень креатинина в сыворотке < 400 мкмоль/л или < 4,5 мг/дл.
Профилактика симптомов (осложнений) со стороны костной ткани у пациентов с костными метастазами распространенных злокачественных опухолей
Перед началом терапии пациентов с множественной миеломой или метастатическим поражением костей при солидных опухолях, а также женщин в постменопаузный период на ранней стадии рака молочной железы, получающих терапию ингибиторами ароматазы, следует определять уровень креатинина в сыворотке и клиренс креатинина. Клиренс креатинина вычисляют на основании уровня креатинина в сыворотке по формуле Кокрофта-Голта. Золеост не рекомендована пациентам, имеющим до начала терапии выраженную почечную недостаточность, при которой клиренс креатинина < 30 мл/мин.
В клинических исследованиях лекарственного препарата Золеост пациенты с уровнем креатинина в сыворотке крови > 265 мкмоль/л или > 3,0 мг/дл были исключены.
Пациентам с метастазами в кости и женщинам в постменопаузный период на ранней стадии рака молочной железы, получающих терапию ингибиторами ароматазы, с легкой или умеренной почечной недостаточностью до начала лечения препаратом Золеост (определяемый клиренс креатинина 30-60 мл/мин), рекомендованы следующие дозы препарата:
Исходный клиренс креатинина (мл/мин) Рекомендуемая доза препарата*
> 60 4,0 мг
50-60 3,5 мг
40-49 3,3 мг
30-39 3,0 мг
* Дозы рассчитаны на основании целевой AUC, составляющей 0,66 (мг · ч/л) (клиренс креатинина = 75 мл/мин). Предполагается, что сниженные дозы с почечной недостаточностью обеспечат достижение тех же значений AUC, что и у пациентов с клиренсом креатинина 75 мл/мин.
После начала терапии уровень креатинина в сыворотке крови следует измерять перед введением каждой дозы препарата Золеост. При нарушении функции почек лечение следует отменить. В клинических исследованиях нарушение функции почек было определено следующим образом:
- для пациентов с нормальным исходным уровнем креатинина в сыворотке (<1,4 мг/дл) – увеличение показателя на 0,5 мг/дл
- для пациентов с измененным исходным уровнем креатинина в сыворотке (> 1,4 мг/дл) – увеличение показателя на 1 мг/дл.
В клинических исследованиях терапию препаратом Золеост возобновляли после возвращения уровня креатинина к значению в пределах 10% от начальной величины. Терапию препаратом следует возобновлять в той же дозе, что и до прерывания лечения.
Способ применения
Внутривенное введение.
4 мг концентрата для приготовления раствора для инфузий препарат Золеост, который в дальнейшем разводится в 100 мл раствора, следует вводить в виде однократной в/в инфузии в течение минимум 15 минут.
У пациентов с нарушением функции почек легкой или средней тяжести рекомендуется применять лекарственный препарат Золеост в сниженных дозах.
Применение у детей
Безопасность и эффективность применения золедроновой кислоты у детей в возрасте от 1 года до 17 лет не установлена.
Инструкции по приготовлению уменьшенных доз препарата Золеост
Возьмите соответствующий объем необходимого жидкого концентрата:
4,4 мл - для дозы 3,5 мг
4,1 мл - для дозы 3,3 мг
3,8 мл - для дозы 3,0 мг
Набранное количество концентрата необходимо развести в 100 мл стерильного 0,9% раствора натрия хлорида или 5% раствора глюкозы. Готовый раствор для инфузии следует вводить в виде однократной внутривенной инфузии в течение не менее 15 минут.
Приготовленный раствор не следует смешивать с кальцием или другими двухвалентными катионосодержащими инфузионными растворами, такими как раствор Рингера, и его следует вводить в виде отдельного внутривенного раствора в отдельной инфузионной линии.
Передозировка
Существуют ограниченные клинические данные об острой интоксикации при передозировке препарата Золеост.
Симптомы: пациенты, получающие дозы препарата, превышающие рекомендованные, должны находиться под тщательным наблюдением, поскольку сообщалось о нарушении функции почек (включая почечную недостаточность) и нарушениях уровней электролитов сыворотки (включая кальций, фосфор и магний).
Лечение: клинически значимую гипокальциемию можно нейтрализовать инфузией глюконата кальция.
При беременности и кормлении
Беременность Достаточные данные о применении золедроновой кислоты у беременных женщин отсутствуют. В исследованиях in vivo выявлено токсическое воздействие на репродуктивную функцию. Потенциальный риск для человека неизвестен. Не следует применять лекарственный препарат Золеост во время беременности. Женщины репродуктивного возраста должны быть предупреждены о необходимости избегать наступления беременности. Период кормления грудью Неизвестно, проникает ли золедроновая кислота в грудное молоко. Применение препарата Золеост в период грудного вскармливания противопоказано. Фертильность Исследования in vivo показали усиленные фармакологические эффекты, которые считаются связанными с ингибированием веществом метаболизма кальция в скелетных мышцах, что приводит к околородовой гипокальциемии, классовому эффекту бисфосфонатов, дистоции и раннему прекращению исследования. Таким образом, эти результаты не позволяют установить определенный эффект золедроновой кислоты на фертильность у человека.
Объём/Вес
Срок годности
3 года
Форма выпуска
Похожие препараты ЗОЛЕОСТ концентрат 5 мл 4 мг/5 мл N1