GERSEPTIN liofilizat 150mg N1
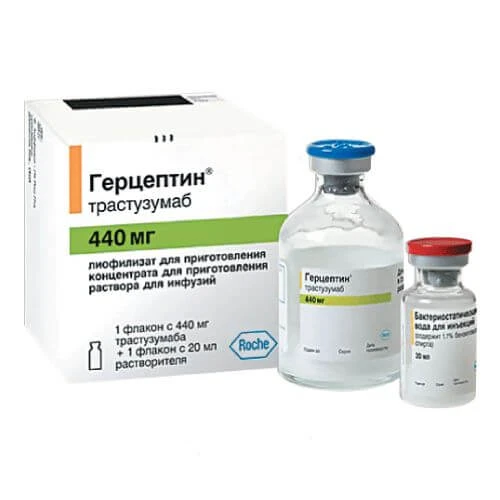
Mahsulotning ko'rinishi saytdagi rasmdan farq qilishi mumkin
Retseptli
Mahsulot haqida tafsilotlar
Ishlab chiqarilgan joyi:Germaniya
Kategoriya:O'smaga qarshi
Faol modda:trastuzumab
Ishlab chiqaruvchi:F.Hoffmann-La Roche Ltd, Shveysariya proizvedeno: Roshe Diagnostics GmbH
ATX kodi:L01XC03
To‘lov va yetkazib berish usullari Toshkentda
Olib ketish
Ertaga yoki keyinroq 0 ta dorixonadan
Dorixonada karta yoki naqd to‘lov
Yetkazib berish
2 soat ichida yoki ertaga, yetkazib berish narxi onlayn dorixonada ko‘rsatilgan tarif bo‘yicha. Onlayn yoki kuryerga to‘lov
GERSEPTIN liofilizat 150mg N1 haqida qo'llanma
Diqqat: ushbu sahifadagi preparat tavsifi rasmiy yo‘riqnomaning soddalashtirilgan va to‘ldirilgan versiyasidir. Ma’lumot faqat tanishish maqsadida taqdim etilgan va o‘z-o‘zini davolash uchun qo‘llanma sifatida foydalanilmasligi kerak. GERSEPTIN liofilizat 150mg N1 preparatini qabul qilishdan oldin albatta shifokor bilan maslahatlashing
GERSEPTIN liofilizat 150mg N1 o'xshash dorilari

Buyuk Britaniya
Vakil:
«NOVATOR PHARMA», YaTT MChJIshlab chiqaruvchi:
«PRIMEA LIMITED»
Narxi
134 400 so'm dan
Narxi
544 000 so'm dan
Narxi
1 150 000 so'm dan

Retseptli
Frantsiya
Vakil:
Les Laboratoires ServierIshlab chiqaruvchi:
Les Laboratoires Servier, Fransiya proizvedeno: Les Laboratoires Servier Industrie
Narxi
25 500 000 so'm dan
Analoglar GERSEPTIN liofilizat 150mg N1
Analoglari yo'q
1
GERSEPTIN liofilizat 150mg N1 haqida savollar
GERSEPTIN liofilizat 150mg N1 haqida fikr-mulohazalar
Reyting 0, 0 ta sharh asosida