Gertseptin
Gertseptin chiqarilish shakllari
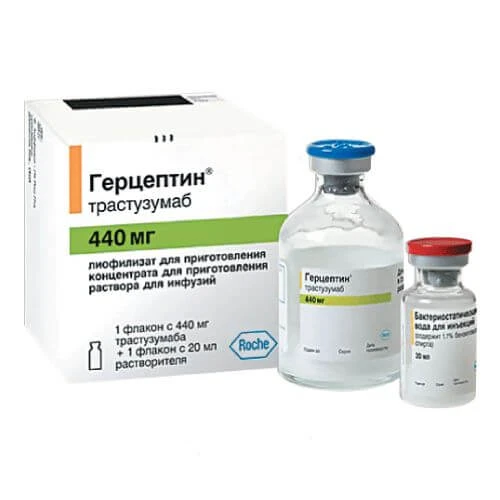
Gertseptin haqida qo'llanma
Umumiy ma'lumot
QO‘LLASH BO‘YICHA YO‘RIQNOMA
GERSEPTIN®
Savdo nomi: Gerseptin®
Xalqaro patentlanmagan nomi: trastuzumab
Dori shakli: infuziya uchun eritma tayyorlash uchun liofilizat
Tarkibi:
Infuziya uchun eritma tayyorlash uchun liofilizatli bir flakon quyidagilarni saqlaydi:
ta‘sir etuvchi modda: trastuzumab – 150 mg;
yordamchi moddalar: L-gistidin gidroxloridi – 3,36 mg, L-gistidin – 2,16 mg, α,α-trigaloza digidrati – 136,2 mg, polisorbat 20 – 0,60 mg.
Ta‘rifi: oqdan to och-sariq rangligacha bo‘lgan liofilizat.
Tayyorlangan eritma – tiniq yoki biroz tovlanuvchi, rangsiz yoki och-sariq rangli suyuqlik.
Farmakoterapevtik guruhi: o‘smalarga qarshi vosita – monoklonal antitelalar.
ATX kodi: L01XC03.
Farmakologik xususiyatlari
Farmakodinamikasi
Trastuzumab rekombinant DNK – gumanizasiyalangan monoklonal antitelalar bo‘lib, ular odam o‘sishi 2 tur epidermal omili (HER2) reseptorlarining hujayradan tashqari domeni bilan tanlab o‘zaro ta‘sirlashadi. Bu antitelalar odam regionlaridan (og‘ir zanjirlarning konstant sohalari) tashkil topgan LgG1 bo‘lib, r185 HER2 antitelalarning sichqon soxalarini HER2 ga komplementarligini belgilaydi.
Proto-onkogen HER2 yoki s-erB2 molekulyar massasi 185 kDa bo‘lgan transmembran reseptorli oqsilni kodlaydi, u tuzilishi bo‘yicha epidermal o‘sish omilining reseptorlarini boshqa oila a‘zolariga o‘xshash. HER2 ning giperekspressiyasi 15-20% bemorlarda birlamchi sut bezi rakining (SBR) to‘qimasida aniqlanadi.
Tarqalgan me‘da raki to‘qimasida HER2-ijobiy statusi aniqlanishining umumiy tez-tezligi pasientlar skriningida 15% IGX (immun-gistoximik reaksiyasi usuli) 3+ va IGX2 +/FISH+ (in situ gibridizasiya usuli) yoki kengroq aniqlash qo‘llanganida 22,1% ni tashkil qilgan. HER2 genining amplifikasiyasi o‘sma hujayralari membranasida HER2 oqsilini giperekspressiyasiga olib keladi, u o‘z navbatida HER2 reseptorining doimiy faollashishini chaqiradi. Reseptorning xujayradan tashqari domeni (ECD, p105) qon oqimiga tushishi mumkin va qon zardobi namunalarida aniqlanadi.
Tadqiqotlar o‘sma to‘qimasida HER2 amplifikasiyasi yoki giperekspressiyasi aniqlangan sut bezining raki bo‘lgan bemorlar, o‘sma to‘qimasida HER2 amplifikasiyasi yoki giperekspressiyasi bo‘lmagan sut bezining raki bo‘lgan bemorlar bilan solishtirganda, kamroq yashab qolishga ega ekanliklarini ko‘rsatadi.
Trastuzumab HER2 in vivo va in vitro gipersekresiyasi bo‘lgan odamning o‘sma hujayralarida proliferasiyani bloklaydi. In vitro sharoitda trastuzumabning antitelaga qaram xujayra sitotoksikligi asosan HER2 giperekspressiyasi bo‘lgan o‘sma hujayralariga qaratilgan.
Immunogenlik
Preparatni vena ichiga olgan 7,0% pasientlarda noad‘yuvant-ad‘yuvant davolashda, trastuzumabga (dastlab antitelalar mavjudligidan qat‘iy nazar) antitelalar paydo bo‘lgan. Bu antitelalarning klinik ahamiyati noma‘lum. Lekin bu antitelalar, ehtimol vena ichiga yuborilganida trastuzumabning farmakokinetikasiga, samaradorligiga (to‘liq patologik javob bo‘yicha aniqlanadigan) yoki xavfsizligiga salbiy ta‘sir ko‘rsatmaydi.
Gerseptin me‘da rakini davolash uchun qo‘llanganida immunogenligi bo‘yicha ma‘lumotlar yo‘q.
Farmakokinetikasi
Trastuzumabning farmakokinetikasi metastatik SBR (SBRm) va erta bosqichlardagi SBR bo‘lgan bemorlarda, shuningdek me‘daning tarqalgan raki bo‘lgan bemorlarda o‘rganilgan. Dorilarning o‘zaro ta‘siri bo‘yicha mahsus tadqiqotlar o‘tkazilmagan.
Sut bezining raki
Preparat haftada bir marta 10, 50, 100, 250 va 500 mg dozada vena ichiga qisqa infuziyalar ko‘rinishida yuborilganida farmakokinetiksi to‘g‘ri chiziqli xarakterga ega bo‘lmagan. Doza oshirilganda preparatning klirensi pasaygan.
Yarim chiqarilish davri
Yarim chiqarilash davri 28-38 kunlarni tashkil qiladi, demak, preparat bekor qilinganidan keyin chiqarilish davri – 27 haftagacha (190 kun yoki 5 yarim chiqarilish davrlari).
Muvozanat holati fonidagi trastuzumabning farmakokinetikasi
Muvozanat holatiga taxminan 27 hafta o‘tgach erishilish kerak. Metastatik SBR ning 1 fazasi, 2 fazasi va 3 fazasi tadqiqotlarning baholashni populyasion farmakokinetik usuli (ikki kamerali model, modelga bog‘liq taxlil), 3 haftadan keyin muvozanat holatida “konsentrasiya-vaqt” (AUC) egri chizig‘i ostidagi maydonining kutilayotgan medianasi, har hafta 3 doza (2 mg/kg) yuborilganidan keyin sutkada 1677 mg/l va 6 mg/kg doza yuborilganida 3 hafta o‘tgach sutkada 1793 mg/l ni tashkil qilgan. Maksimal konsentrasiyasining (Cmax) muvofiq 104 mg/l va 189 mg/l, minimal konsentrasiyasi (Cmin) esa – 64,9 mg/l va 47,3 mgn/l ni tashkil qilgan. Erta bosqichlaradagi SBR bo‘lgan 8 mg/kg yuklama, so‘ngra xar 3 haftada 6 mg/kg samarani bir maromda saqlab turuvchi dozada trastuzumab qabul qilgan pasientlarda, 18 siklning 21 kunida (1 yil davomiyligidagi davolashning oxirgi siklida) muvozanat holatida o‘rtacha Cmin 68,9 mkg/ml, Cmax esa – 225 mkg/ml ni tashkil qilgan va mSBR bo‘lgan bemorlardagi bilan bir xil bo‘lgan.
Klirensi
Trastuzumabning tipik klirensi (tana massasi 68 kg bo‘lgan pasient uchun) sutkada
0,241 l ni tashkil qilgan.
Taqsimlanish hajmi
Barcha klinik tadqiqotlarda tipik pasient uchun markaziy kameradagi (Vc) taqsimlanish hajmi 3,02 l ni, periferikda (Vp) – 2,68 l ni tashkil qilgan.
HER2-reseptorining (antigen hujayrasidan “ko‘chib chiquvchi”) aylanib yuruvchi xujayradan tashqari domeni
SBR va HER2 giperekspressiyasi bo‘lgan ayrim pasientlarning qon zardobida HER2-reseptorining (hujayradan “ko‘chib chiquvchi” antigen) aylanib yuruvchi xujayradan tashqari domeni aniqlangan. Tekshirilgan pasientlarning 64% da zardobning dastlabki namunalarida 1880 ng/ml ga yetuvchi (medianasi 11 ng/ml) konsentrasiyalarda hujayradan “ko‘chib chiquvchi” antigen aniqlangan. Hujayradan “ko‘chib chiquvchi” antigenning konsentrasiyasini yuqori darajasiga ega bo‘lgan pasientlar, ehtimol, pastroq Cmin ga ega bo‘lishlari mumkin. Lekin hujayradan “ko‘chib chiquvchi” antigenning konsentrasiyasini yuqori darajasiga ega bo‘lgan ko‘pchilik pasientlarda preparat har haftada yuborilganida, trastuzumabning zardobdagi kutilgan konsentrasiyasiga 6 haftaga kelib erishilgan. Hujayradan “ko‘chib chiquvchi” antigenning dastlabki darajasi va klinik javob orasida ahamiyatli aloqa kuzatilmagan.
Me‘daning tarqalgan raki
Muvozanat holati fonidagi trastuzumabning farmakokinetikasi
Me‘daning tarqalgan raki bo‘lgan pasientlarda 8 mg/kg yuklama, keyingi xar 3 haftada
6 mg/kg doza yuborish bilan trastuzumab yuborilganidan keyin muvozanat holati fonida trastuzumabning farmakokinetikasini baxolash uchun, 3 faza tadqiqotlarning ma‘lumotlarini ishlatish bilan to‘g‘ri chiziqli bo‘lmagan ikki kamerali populyasion farmakokinetik usul qo‘llangan.
Qon zardobidagi trastuzumabning konsentrasiyasini kuzatilgan darajasi past bo‘lgan, shunday qilib, preparatning umumiy klirensi me‘daning tarqalgan raki bo‘lgan pasientlarda, xuddi shu dozada trastuzumab qabul qilgan SBR bo‘lgan pasientlardagiga nisbatan yuqoriligi aniqlangan. Buning sababi noma‘lum.
Yuqori konsentrasiyalarda umumiy klirens asosan to‘g‘ri chiziqli xarakterga ega, yarim chiqarilish davri esa taxminan 26 kunni tashkil qiladi.
AUC ning taxmin qilingan ko‘rsatgichining medianasi (3 hafta davr davomidagi muvozanat holatida) sutkada 1213 mg/l ni, muvozanat holatidagi Cmax ning medianasi – 132 mg/l ni, Cmin medianasi – 27,6 mg/l ni tashkil qiladi.
Me‘da raki bo‘lgan pasientlar zardobidagi HER2-reseptorining (hujayradan “ko‘chib chiquvchi” antigen) aylanib yuruvchi xujayradan tashqari domeni darajasi haqida ma‘lumotlar yo‘q.
Alohida guruh pasientlardagi farmakokinetikasi
Keksa yoshdagi pasientlarda va buyrak yoki jigar yetishmovchiligi bo‘lgan pasientlarda alohida farmakokinetik tadqiqotlar o‘tkazilmagan.
Keksalik yoshi
Yosh trastuzumabni taqsimlanishiga ta‘sir qilmaydi.
Qo‘llanilishi
Sut bezining raki
O‘smali HER2 giperekspressiyasi bo‘lgan sut bezining metastatik raki:
- monoterapiya ko‘rinishida, bir yoki ko‘proq ximioterapiya sxemalaridan keyin;
- ilgari ximioterapiya bo‘lmagan xolda paklitaksel yoki dosetaksel bilan majmuada (birinchi yo‘nalish terapiyasi);
- postmenopauzadagi ayollarda ijobiy gormonal reseptorlarda (estrogenli va/yoki progesteronli) aromataza ingibitorlari bilan majmuada.
O‘smali HER2 giperekspressiyasi bo‘lgan sut bezi rakining erta bosqichlari:
- jarrohlik aralashuv o‘tkazilganidan keyin, ximioterapiya (noad‘yuvant yoki ad‘yuvant) va nur bilan davolash yakunlanganidan keyin ad‘yuvant davolash sifatida;
- doksorubisin va siklofosfamid bilan ad‘yuvant ximioterapiyadan keyin paklitaksel yoki dosetaksel bilan ad‘yuvant davolash ko‘rinishida;
- dosetaksel va karboplatindan tashkil topgan ad‘yuvant ximioterapiya bilan majmuada;
- mahalliy tarqalgan (shu jumladan yallig‘langan shakli) kasallikda yoki o‘smaning diametri 2 sm dan katta bo‘lmagan o‘lchami hollarida, noad‘yuvant ximioterapiya bilan majmuada va keyingi Gerseptin preparati bilan ad‘yuvant monterapiya.
Me‘daning tarqalgan raki
O‘smali HER2 giperekspressiyasi bo‘lgan me‘daning yoki qizilo‘ngach-me‘da o‘tish joyining tarqalgan adenokarsinomasi:
- metastatik kasallik bo‘yicha ilgarigi o‘smalarga qarshi davolash bo‘lmagan holda kapesitabin yoki vena ichiga ftorurasil va platina preparatlarini yuborish bilan majmuada qo‘llanadi.
Qo‘llash mumkin bo‘lmagan holatlar
Trastuzumabga, preparatning har qanday komponentiga yoki sichqonning oqsiliga yuqori sezuvchanlik.
Homiladorlik va emizish davri.
18 yoshgacha bo‘lgan bolalarda (bolalarda samaradorligi va xavfsizligi aniqlanmagan).
Tinch holatda o‘pkadagi metastazlar chaqirgan yoki kislorod bilan saqlab turuvchi davolashni talab qiluvchi og‘ir hansirash.
Anamnezida miokard infarkti, stenokardiyasi, davolashni talab qiluvchi surunkali yurak yetishmovchiligi (NYHA bo‘yicha II va IV funksional sinfi), ChQCHTF <55%, kardiomiopatiya, aritmiya, klinik ahamiyatli yurak nuqsonlari, nazorat qilinmaydigan arterial gipertenziyasi, gemodinamik ahamiyatli perikardial suyuqligi bo‘lgan SBR erta bosqichlaridagi bemorlar (bu guruh pasientlardagi samaradorligi va xavfsizligi o‘rganilmagan); SBR ning erta bosqichlaridagi pasientlarda ad‘yuvant terapiya tarkibida preparatni antrasiklinlar bilan bir vaqtda qo‘llash mumkin emas.
Ehtiyotkorlik bilan
Yurak ishemik kasalligi, arterial gipertenziya, yurak yetishmovchiligi, o‘pkaning yondosh kasalliklari yoki o‘pkaga metastazlar, kardiotoksik dori vositalari, shu jumladan antrasiklinlar/siklofosfamid bilan oldingi davolash, chap qorinchaning chiqarib tashlash fraksiyasi (ChQCHTF) <55%, kasallarda ehtiyotkorlik bilan qo‘llanadi.
Homiladorlik va emizish davrida qo‘llanishi
Homiladorlik
Bola tug‘ish yoshidagi ayollar Gerseptin® preparati bilan davolanish vaqtida va, davolash tugaganidan keyin eng kamida 7 oy davomida kontrasepsiyaning ishonchli usullarini ishlatishlari kerak.
Homiladorlik yuz bergan holda homilaga zararli ta‘siri mumkinligi haqida ayolni ogohlantirib qo‘yish kerak. Agar homilador Gerseptin preparati bilan davolash olishni davom ettirsa, unda u turli mutaxassislikdagi shifokorlarning sinchikov nazorati ostida bo‘lishi kerak (“Qo‘llash mumkin bo‘lmagan holatlar” bo‘limiga ham qarang).
Gerseptinni ayollarning reproduktiv qobiliyatiga ta‘siri noma‘lum. Hayvonlardagi eksperimentlarda fertillikning buzilish belgilarini yoki homilaga salbiy ta‘siri aniqlanmagan.
Emizish davri
Davolanish vaqtida va Gerseptin preparati bilan davolanish tugaganidan keyin eng kamida 7 oy davomida ko‘krak suti bilan boqish tavsiya etilmaydi (“Qo‘llash mumkin bo‘lmagan holatlar” bo‘limiga ham qarang).
Qo‘llash usuli va dozalari
Gerseptin preparati bilan davolashni boshlashgacha o‘smali HER2 ekspressiyaga test o‘tkazish shart hisoblanadi.
Gerseptin preparati bilan davolash sitotoksik ximioterapiyani qo‘llash faqat tajribasiga ega bo‘lgan shifokor kuzatuvi ostida o‘tkazilishi kerak, preparat esa tibbiyot xodimi tomonidan yuborilishi kerak.
Gerseptin® “infuziya uchun eritma tayyorlash uchun liofilizat” dori shaklida faqat vena ichiga tomchilab yuboriladi! Preparatni vena ichiga oqim bilan yoki bolyusli yuborish mumkin emas!
Diqqat!
Oqsilning agregasiyasi mumkinligi tufayli Gerseptin® 5% li dekstroza eritmasi bilan nomutanosib.
Gerseptin®ni boshqa dori preparatlari bilan birga aralashtirish yoki suyultirish mumkin emas.
Gerseptin® preparatining eritmasi polivinilxlorid, polietilen va polipropilendan tayyorlangan infuzion paketlar bilan mutanosib.
Eritmani tayyorlash
Preparatni yuborishga tayyorlash aseptik sharoitlarda o‘tkazilishi kerak.
Eritmani tayyorlash bo‘yicha yo‘riqnoma
150 mg Gerseptin® preparati bo‘lgan flakon ichidagisi 7,2 ml in‘eksiya uchun steril suvda eritiladi.
Eritish vaqtida preparat bilan ehtiyotkorlik bilan muomala qilish kerak. Eritishda oshiqcha ko‘pik hosil bo‘lishidan saqlanish kerak, ko‘pik preparatning kerakli dozasini flakondan olishni qiyinlashtirishi mumkin.
- 150 mg Gerseptin® preparati bo‘lgan flakonga steril shpris bilan 7,2 ml in‘eksiya uchun steril suv asta-sekin, suyuqlikning oqimini to‘g‘ri liofilizatga yo‘naltirib kiritiladi.
- Eritish uchun flakon aylanma xarakatlar bilan ehtiyotkorlik bilan tebratiladi. Silkitilmasin!
Preparat eritilganida ko‘pincha ko‘p bo‘lmagan miqdorda ko‘pik hosil bo‘ladi. Bundan saqlanish uchun eritmaga taxminan 5 minut muhlat berish kerak. Tayyorlangan eritma tiniq va rangsiz yoki och-sariq rangli bo‘lishi kerak.
Tayyorlangan eritmani saqlash sharoiti
150 mg preparatli flakon faqat bir marta ishlatiladi.
Gerseptin preparatining eritmasi in‘eksiya uchun steril suvda eritilganidan keyin 2-8oS haroratda 24 soat davomida fizik va kimyoviy turg‘un.
Infuziya uchun eritma tayyorlashni bevosita liofilizat eritilganidan keyin amalga oshirish kerak. Istisno hollarda liofilizat tayyorlanganidan keyin, agar liofilizatni tayyorlash nazoratli va validasiyalangan aseptik sharoitlarda o‘tkazilgan bo‘lsa, eritma 2-8oS haroratda 24 soatdan ko‘p bo‘lmagan vaqt saqlanishi mumkin. Bunda saqlash sharoitiga (saqlash tartibi va davomiyligi), liofilizatni eritgan mutaxassis javob beradi.
Infuziya uchun eritma tayyorlash bo‘yicha yo‘riqnoma
Eritmaning hajmini aniqlash:
– trastuzumabning yuborish uchun kerak bo‘lgan tana vazniga 4 mg/kg ga teng yuklama dozasi, yoki 2 mg/kg ga teng samarani bir maromda saqlab turuvchi dozasi, quyidagi formula bo‘yicha aniqlanadi:
tana vazni (kg) x doza (4 mg/kg yuklama yoki 2 mg/kg samarani bir
maromda saqlab turuvchi)
Hajm (ml) = ————————————————————————————————–
21 (mg/ml, tayyorlangan eritmaning konsentrasiyasi)
– trastuzumabning yuborish uchun kerak bo‘lgan tana vazniga 8 mg/kg ga teng yuklama dozasi, yoki har 3 haftada yuboriladigan 6 mg/kg ga teng samarani bir maromda saqlab turuvchi dozasi, quyidagi formula bo‘yicha aniqlanadi:
tana vazni (kg) x doza (8 mg/kg yuklama yoki 6 mg/kg samarani bir
maromda saqlab turuvchi)
Hajm (ml) = ————————————————————————————————–
21 (mg/ml, tayyorlangan eritmaning konsentrasiyasi)
Eritilgan liofilizatli flakondan kerakli hajmda olish va uni 250 ml 0,9% li natriy xloridining eritmasi bo‘lgan infuzion paketga yuborish kerak. So‘ngra infuzion paketni eritma aralashishi uchun, ko‘pik hosil bo‘lishidan saqlanib, ehtiyotkorlik bilan to‘nkarish kerak. Eritmani yuborish oldidan mexanik aralashmalar yo‘qligiga va rangini o‘zgarmaganligiga (vizual) tekshirish kerak. Infuziya uchun eritmani u tayyorlanganidan keyin darhol yuborilishi kerak.
Istisno hollarda infuziya uchun tayyorlangan eritma, agar liofilizatni eritish yoki infuziya uchun eritmani tayyorlash nazoratli va validasiyalangan aseptik sharoitlarda o‘tkazilgan bo‘lsa, 2-8oS haroratda 24 soatdan ko‘p bo‘lmagan vaqt saqlanishi mumkin. Bunda saqlash sharoitiga (saqlash sharoiti va davomiyligi), eritmani tayyorlagan mutaxassis javob beradi.
Ishlatilmagan yoki yaroqlilik muddati o‘tgan preparatni utilizasiyasi bo‘yicha yo‘riqnoma
Dori preparatini atrof-muhitga tushishini minimumga yetkazish kerak. Preparatni oqova suvlar yordamida yoki maishiy chiqindilar bilan birga utilizasiya qilish mumkin emas. Dori preparatini utilizasiyasi uchun iloji boricha maxsus tizimlarni ishlatish kerak.
Dozalashning standart tartibi
Trastuzumabni har bir yuborish vaqtida pasientda etni uvishishi, isitma yoki boshqa infuzion reaksiyalar paydo bo‘lishiga sinchiklab kuzatish kerak (birinchi infuziya boshlanganidan keyin 6 soat davomida va keyingi infuziyalar boshlanganidan keyin 2 soat davomida). Shoshilinch yordam ko‘rsatish uchun to‘plam tayyor bo‘lishi kerak, infuziyani esa anafilaksiyani davolash tajribasiga ega bo‘lgan tibbiy mutaxassis o‘tkazishi kerak.
Infuzion reaksiyalar paydo bo‘lgan holda infuziya to‘xtatiladi. Og‘irligi yengil yoki o‘rtacha darajali infuzion reaksiyalarning simptomlari yo‘qolganidan keyin NCI-CTC ga (toksiklikning AQSH rakning Milliy institutining umumiy mezonlari) muvofiq infuziyani qayta tiklash mumkin. Og‘ir va hayotga xavf soluvchi infuzion reaksiyalar rivojlangan xolda, Gerseptin preparati bilan keyingi davolashni to‘xtatish masalasini ko‘rib chiqish kerak.
Sut bezining metastatik raki
Har haftada yuborish
Yuklama doza: 90 minutlik vena ichiga tomchili infuziya ko‘rinishida tana vazniga 4 mg/kg.
Samarani bir maromda turuvchi doza: tana vazniga 2 mg/kg haftada bir marta. Samarani bir maromda saqlab turuvchi doza yuklama dozadan keyin 1 hafta o‘tgach yuboriladi. Agar oldingi yuklama doza yaxshi o‘zlashtirilgan bo‘lsa, preparatni 30 minutlik tomchili infuziya ko‘rinishida yuborish mumkin.
Muqobil yuborish – 3 hafta o‘tgach.
Yuklama doza: 90 minutlik vena ichiga tomchili infuziya ko‘rinishida tana vazniga 8 mg/kg.
Samarani bir maromda saqlab turuvchi doza: tana vazniga 6 mg/kg xar 3 haftada. Samarani bir maromda saqlab turuvchi doza yuklama dozadan keyin 3 hafta o‘tgach yuboriladi. Agar oldingi yuklama doza yaxshi o‘zlashtirilgan bo‘lsa, preparatni 30 minutlik tomchili infuziya ko‘rinishida yuborish mumkin.
Paklitaksel yoki dositaksel bilan majmuada qo‘llash
Paklitaksel yoki dositaksel Gerseptin preparati yuborilganidan keyingi kuni (dozalash bo‘yicha tavsiyalarni tibbiyotda qo‘llash bo‘yicha muvofiq yo‘riqnomalardan qarang) yoki agar Gerseptin® preparatini oldingi yuborish yaxshi o‘zlashtirilgan bo‘lsa, darhol yuborilgan.
Aromataza ingibitorlari bilan majmuada qo‘llash
Gerseptin® va anastrozol 1 kuni yuborilgan. Gerseptin® preparatini va anastrozolni yuborish bo‘yicha cheklanishlar bo‘lmagan (dozalash bo‘yicha tavsiyalarni anastrozolni tibbiyotda qo‘llash bo‘yicha yo‘riqnomasidan qarang).
Sut bezi rakining erta bosqichlari
Har haftada yuborish
Har haftalik yuborishda Gerseptin® tana vazniga 4 mg/kg yuklama dozada, keyinchalik haftada bir marta tana vazniga 2 mg/kg samarani bir maromda saqlab turuvchi dozada yuboriladi. Samarani bir maromda saqlab turuvchi doza yuklama doza yuborilganidan keyin 1 hafta o‘tgach yuboriladi. Yuklama doza 90 minutlik vena ichiga tomchili infuziya ko‘rinishida yuboriladi. Agar oldingi yuklama doza yaxshi o‘zlashtirilgan bo‘lsa, preparatni 30 minutlik tomchili infuziya ko‘rinishida yuborish mumkin.
3 haftadan keyin yuborish
3 haftadan keyin yuborishdagi yuklama doza: tana vazniga 8 mg/kg (90 minutlik vena ichiga tomchili infuziya ko‘rinishida).
Samarani bir maromda saqlab turuvchi doza: tana vazniga 6 mg/kg har 3 haftada. Samarani bir maromda saqlab turuvchi doza yuklama dozadan keyin 3 hafta o‘tgach yuboriladi. Agar oldingi yuklama doza yaxshi o‘zlashtirilgan bo‘lsa, preparatni 30 minutlik tomchili infuziya ko‘rinishida yuborish mumkin.
Sut bezi rakining erta bosqichlarida Gerseptin® preparatini qo‘llash, quyida ta‘riflangan sxemalarga muvofiq ximioterapiya bilan majmuada o‘rganilgan.
Doksorubisin va siklofosfamid bilan ximioterapiyadan keyin paklitaksel yoki dosetaksel bilan majmuada qo‘llash
Paklitaksel:
80 mg/m2 davomli vena ichiga infuziya ko‘rinishida , har haftada, 12 hafta davomida
yoki
175 mg/m2 davomli vena ichiga infuziya ko‘rinishida, har 3 haftada 4 sikllar davomida (har siklning 1 kuni).
Dosetaksel:
100 mg/m2 vena ichiga infuziya ko‘rinishida 1 soat davomida, har 3 haftada, 3 sikllar davomida (5 siklning 2 kunidan boshlab, keyinchalik xar bir navbatdagi siklning 1 kuni).
Gerseptin®:
Paklitaksel yoki dosetakselning birinchi dozasidan boshlab Gerseptin® ximioterapiya vaqtida xar haftalik sxemaga muvofiq yuborilgan (yuklama doza 4 mg/kg, keyinchalik xar haftada 2 mg/kg samarani bir maromda saqlab turuvchi doza).
Keyinchalik Gerseptin® bilan monoterapiya paklitaksel bilan majmuaviy qo‘llashdan keyin har haftalik sxemaga muvofiq yoki dosetaksel bilan majmuada qo‘llanganidan keyin 3 hafta o‘tgach yuborishga muvofiq davom ettirilgan. Gerseptin® bilan umumiy davolash davomiyligi, olingan yoki o‘tkazib yuborilgan dozalardan qat‘iy nazar, birinchi yuborilgan vaqtdan boshlab 1 yilni tashkil qilgan. Agar paklitaksel yoki dositaksel va Gerseptin® preparatini bir kunda yuborish kerak bo‘lsa, unda paklitaksel yoki dosetaksel birinchi yuborilgan.
Dosetaksel va karboplatin bilan majmuada qo‘llash
Dosetaksel/Karboplatin (birinchi siklning 2 kunidan boshlab har 3 haftada 6 sikl davomida, keyinchalik har navbatdagi siklning 1 kuni):
Dosetaksel 75 mg/m2 dozada vena ichiga infuziya ko‘rinishida 1 soat davomida, undan keyin karboplatin vena ichiga infuziya ko‘rinishida kutilgan AUC – minutiga 6 mg/ml ga erishish uchun dozada 30-60 minut davomida yuboriladi.
Gerseptin®: Gerseptin® ximioterapiya bilan birga xar haftalik sxemaga muvofiq yuborilgan (yuklama doza 4 mg/kg, keyinchalik xar haftada 2 mg/kg samarani bir maromda saqlab turuvchi doza). Ximioterapiyadan keyin Gerseptin® bilan monoterapiya 3 hafta o‘tgach yuborishga muvofiq davom ettirilgan. Gerseptin bilan umumiy davolash davomiyligi, olingan yoki o‘tkazib yuborilgan dozalardan qat‘iy nazar, birinchi yuborilgan vaqtdan boshlab 1 yilni tashkil qilgan. Agar dositaksel, karboplatin va Gerseptin preparatini bir kunda yuborish kerak bo‘lsa, unda dosetaksel birinchi, undan keyin karboplatin, keyin Gerseptin yuborilgan.
Noad‘yuvant-ad‘yuvant terapiya
Gerseptin® tartibga muvofiq noad‘yuvant ximioterapiya bilan majmuada xar 3 haftada yuborilgan (10 sikl):
doksorubisin 60 mg/m2 va paklitaksel 150 mg/m2, har 3 haftada, 3 sikl davomida;
keyinchalik paklitaksel 150 mg/m2, har 3 haftada, 4 sikl davomida;
keyinchalik siklofosfamid, metotreksat va ftorurasil 1 va 8 kunlari, har 4 haftada, 3 sikl davomida.
Jarrohlik aralashuv o‘tkazilganidan keyin Gerseptin® preparati bilan monoterapiya tartibga muvofiq har 3 haftada davom ettirilgan.
Gerseptin® preparati bilan davolash umumiy davomiyligi 1 yilni tashkil qilgan.
Me‘daning tarqalgan raki
3 hafta o‘tgach yuborish
Yuklama doza: tana vazniga 8 mg/kg 90 minutlik vena ichiga tomchili infuziya ko‘rinishida.
Samarani bir maromda saqlab turuvchi doza: tana vazniga 6 mg/kg har 3 haftada. Samarani bir maromda saqlab turuvchi doza yuklama dozadan keyin 3 hafta o‘tgach yuboriladi. Agar oldingi doza yaxshi o‘zlashtirilsa, preparatni 30 minutlik tomchili infuziya ko‘rinishida yuborish mumkin.
SBR metastatik va erta bosqichlari va me‘daning tarqalgan raki
Davolash davomiyligi
Metastatik SBR yoki me‘daning tarqalgan raki bo‘lgan pasientlarda Gerseptin® preparati bilan davolash kasallik avj olishgacha o‘tkaziladi. SBR erta bosqichlari bo‘lgan pasientlar Gerseptin® bilan davolashni 1 yil davomida yoki kasallikni qaytalanishigacha (qaysi biri tezroq yuz terishiga qarab) olishlari kerak. SBR erta bosqichlari bo‘lgan pasientlarni Gerseptin® bilan bir yildan ortiq davolash tavsiya etilmaydi.
Rejali yuborishdagi o‘tkazib yuborish
Agar trastuzumabni rejali yuborishda o‘tkazib yuborish 7 kun yoki kamroq bo‘lsa, navbatdagi rejali yuborishni kutmasdan iloji boricha tezroq preparatni odatdagi samarani bir maromda saqlab turuvchi dozada yuborish kerak (har haftalik tartib: tana vazniga 2 mg/kg; har 3 haftalik rejim: tana vazniga 6 mg/kg). Keyinchalik preparat samarani bir maromda saqlab turuvchi dozada belgilangan rejaga muvofiq yuboriladi (har haftalik tartib: tana vazniga 2 mg/kg; har 3 haftalik rejim: tana vazniga 6 mg/kg).
Agar trastuzumabni rejali yuborishda o‘tkazib yuborish 7 kundan ko‘proqni tashkil qilgan bo‘lsa, trastuzumabning yuklama dozasini 90 minutlik vena ichiga infuziya ko‘rinishida yuborish kerak (har haftalik tartib: tana vazniga 4 mg/kg; har 3 haftalik tartib: tana vazniga 8 mg/kg). So‘ngra preparatni samarani bir maromda saqlab turuvchi dozada yuborish davom ettiriladi (har haftalik tartib: tana vazniga 2 mg/kg; har 3 haftalik tartib: tana vazniga 6 mg/kg).
Dozaga tuzatish kiritish
Ximioterapiya chaqirgan qaytuvchan mielosupressiya paydo bo‘lgan davrda Gerseptin® p