KSELODA tabletkalari 500mg N120
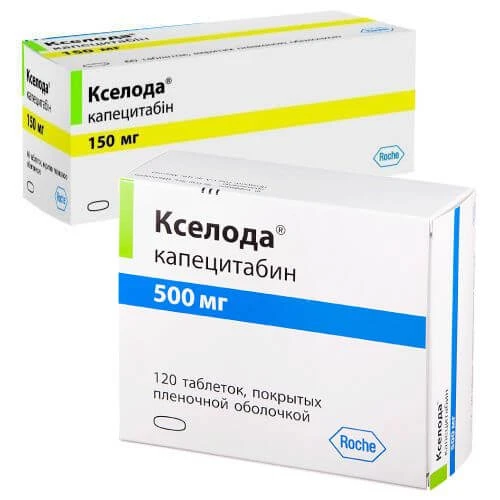
Mahsulotning ko'rinishi saytdagi rasmdan farq qilishi mumkin
Mahsulot haqida tafsilotlar
Ishlab chiqarilgan joyi:Meksika
Kategoriya:O'smaga qarshi
Faol modda:Kapesitabin
Ishlab chiqaruvchi:F.Hoffmann-La Roche Ltd, Shveysariya proizvedeno: Productos Roche S.A. de C.V.
ATX kodi:L01BC06
To‘lov va yetkazib berish usullari Toshkentda
Olib ketish
Ertaga yoki keyinroq 1 ta dorixonadan
Dorixonada karta yoki naqd to‘lov
Yetkazib berish
2 soat ichida yoki ertaga, yetkazib berish narxi onlayn dorixonada ko‘rsatilgan tarif bo‘yicha. Onlayn yoki kuryerga to‘lov
KSELODA tabletkalari 500mg N120 qo'llanmasi
Qadoqda soni
120
Hajm/og'irlik
500мг
Diqqat: ushbu sahifadagi preparat tavsifi rasmiy yo‘riqnomaning soddalashtirilgan va to‘ldirilgan versiyasidir. Ma’lumot faqat tanishish maqsadida taqdim etilgan va o‘z-o‘zini davolash uchun qo‘llanma sifatida foydalanilmasligi kerak. KSELODA tabletkalari 500mg N120 preparatini qabul qilishdan oldin albatta shifokor bilan maslahatlashing
KSELODA tabletkalari 500mg N120 o'xshash dorilari
KSELODA tabletkalari 500mg N120 analoglari
Narxi
310 800 so'm dan
Retseptli
Germaniya
Ishlab chiqaruvchi:
Sandoz Pharmaceuticals d.d., Sloveniya proizvedeno: Salutas Pharma GmbH
Retseptli
Germaniya
Ishlab chiqaruvchi:
Sandoz Pharmaceuticals d.d., Sloveniya proizvedeno: Salutas Pharma GmbH
Retseptli
Germaniya
Ishlab chiqaruvchi:
Sandoz Pharmaceuticals d.d., Sloveniya proizvedeno: Salutas Pharma GmbH
KSELODA tabletkalari 500mg N120 narxlari va Toshkentdagi dorixonalardagi mavjudligi
Evo Med
Yunusobod tumani, Binkat ko'ch., 14 uy
Du, Se, Ch, Pa, Ju, Sh, Ya | 06:30-00:00
2 293 900 so'm
{
"data": {
"id": 58791,
"stores_apteka_id": 333044,
"slug": "kseloda-tabletki",
"stores_apteka_slug": "kseloda-tab-500mg-n120",
"name": "KSELODA tabletkalari 500mg N120",
"brand_name": "KSELODA",
"image": "uploads/iblock/191/191de1c29f3b3c6bb240b6d21e6e77d9.webp",
"atx_code": "L01BC06",
"drug_form_id": 1,
"over_the_counter": false,
"prescription_type": "unknown",
"availability": "not_available",
"reviews_count": 0,
"reviews_rating": 0,
"has_pickup": false,
"has_delivery": false,
"manufacturer": null,
"manufacturer_plain": "F.Hoffmann-La Roche Ltd, Shveysariya proizvedeno: Productos Roche S.A. de C.V.",
"representative": null,
"representative_plain": null,
"distributor": null,
"distributor_plain": null,
"is_manufacturer_advertiser": false,
"is_representative_advertiser": false,
"is_dietary_supplement": false,
"is_medical_device": false,
"category": {
"id": 483,
"slug": "protivoopukholevye",
"name": "O'smaga qarshi",
"external_link_title": "",
"external_link": ""
},
"drug_group": {
"id": 5240,
"slug": "kseloda",
"name": "Kseloda"
},
"is_purchasable": true,
"country": {
"id": 188,
"slug": "meksika",
"name": "Meksika"
},
"active_ingredients": [
{
"id": 7480,
"slug": "kapetsitabin",
"name": "Kapesitabin"
}
],
"tags": []
}
}
KSELODA tabletkalari 500mg N120 haqida savollar
KSELODA tabletkalari 500mg N120 haqida fikr-mulohazalar
Reyting 0, 0 ta sharh asosida