ЭМОКЛОТ лиофилизат 1000ме N1
Гемостатик
Инструкция ЭМОКЛОТ лиофилизат 1000ме N1
Особые условия хранения
Хранить при 2 °С - 8 °С (в холодильнике) в оригинальной упаковке в картонной коробке, в защищенном от света месте. Беречь от детей.
Фармакотерапевтическая группа
Гемостатик
Лекарственная форма
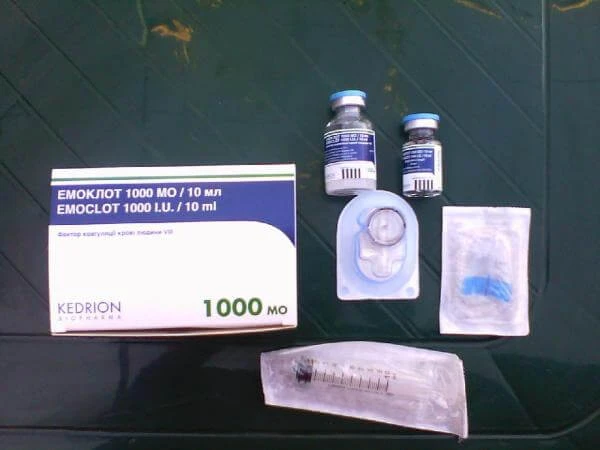
Лиофилизат для приготовления раствора для инфузий 500 МЕ, 1000 МЕ N1 (флаконы) в комплекте с растворителем - вода для инъекций 10 мл N1 (флаконы)
Особые условия хранения
Как и в случаях с любым белковым препаратом для внутривенного введения возможно возникновение аллергических реакций.
Препарат содержит следы белков человека, не являющихся фактором VIII. Пациенты должны быть осведомлены о ранних признаках аллергических реакций , к которым относятся крапивница, генерализованная аллергическая сыпь, затрудненность дыхания, свистящее дыхание, гипотония и анафилаксия. В случае проявления данных симптомов рекомендуется немедленно прекратить прием препарата и обратиться к лечащему врачу. При возникновении шока следует провести противошоковую терапию в соответствии со стандартами неотложной медицинской помощи.
При введении лекарственных препаратов, произведенных из крови или плазмы крови человека, нельзя полностью исключить передачу инфекционных агентов, в т.ч. пока еще неизвестных. Риск передачи болезнетворных факторов уменьшен благодаря:
- отбору доноров по результатам медицинского опроса и скрининга индивидуальных донорских проб и пулов крови на поверхностный антиген вируса гепатита В, на антитела к вирусу иммунодефицита человека и на антитела к вирусу гепатита С;
- тестированию пулов плазмы крови на выявление генома вируса гепатита С; присутствию в процессе производства стадий вирусной инактивации. Валидации подвергаются два этапа производственного процесса: первый - химическая инактивация посредством обработки смесью растворителя и детергента в соответствии с патентом Нью-йоркского центра переливания крови, второй - физическая инактивация посредством термообработки при 100 °С в течение 30 минут в лиофильном состоянии.
- Эффективность инактивации доказана для ВИЧ и вируса гепатита А, а также для вируса диареи крупного рогатого скота (BVDV) и вирус псевдобешенства (PRV), которые считаются модельными вирусами для вирусов гепатита С и гепатита В. Не исключается риск передачи парвовируса В19 вследствие текущего использования всех противовирусных методов.
Всем пациентам, получающим фактор VIII, произведенный из плазмы крови, рекомендуется пройти вакцинацию (против гепатита А и В).
Инфицирование парвовирусом В19 может иметь серьезные последствия в период беременности (внутриутробная инфекция), а также для людей с иммунодефицитом или повышенной выработкой эритроцитов (напр., при гемолитической анемии).
Образование нейтрализующих антите общепризнанным осложнением при лечении гемофилии А. Этими ингибиторами обычно являются иммуноглобулины G, действующие против прокоагулянтной активности фактора VIII. Количество иммуноглобулинов G измеряется в единицах Бетезда (БЕ) в мл плазмы крови на основе модифицированного количественного анализа. Риск образования ингибиторов связан с воздействием антигемофилического фактора VIII.Наибольшая вероятность этого риска сохраняется в течение первых 20 дней применения препарата. Ингибиторы редко могут образовываться по прошествии первых 100 дней применения препарата. Пациенты, проходящие курс лечения фактором свертывания крови VIII, должны подвергаться тщательному исследованию на предмет выявления ингибиторов посредством соответствующих клинических наблюдений и проведения лабораторных исследований.
По возможности, в интересах пациентов рекомендуется при введении им ЭМОКЛОТ А регистрировать название и номер серии препарата.
Нет сведений о влиянии фактора свертывания крови VIII на вожможность управления автомобильным транспортом или работу с механизмами.
Показания
- Лечение и профилактика кровотечений недостаток фактора VIII;
- Лечение приобретенного недостатка фактора VIII;
- Лечение больных гемофилией вследствие спонтанного появления ингибиторов фактора VIII.
Противопоказания
Повышенная чувствительность к активному веществу или вспомогательным веществам.
Лекарственное взаимодействие
Данных о взаимодействии фактора свертывания крови VIII с другими лекарственными препаратами нет.
Несовместимость
ЭМОКЛОТ нельзя смешивать с другими лекарственными препаратами.
Помимо систем, входящих в состав упаковки, следует использовать только утвержденные системы для инъекций/инфузий, совместимые с раствором фактора VIII, поскольку процедура введения может прерваться вследствие абсорбции фактора свертывания крови VIII на внутренних поверхностях систем для введения.
Дозировка
Дозировка и продолжительность заместительной терапии зависят от степени тяжести дефицита фактора VIII, локализации и степени кровотечения, а также от тяжести клинического состояния пациента.
Количество вводимых единиц фактора VIII выражается в Международных единицах (ME), соответствующих действующему стандарту ВОЗ по препаратам фактора VIII. Активность фактора VIII в плазме крови выражается либо в процентах (по сравнению с обычной плазмой крови человека), либо в Международных единицах (по сравнению с международным стандартом по фактору VIII в плазме крови).
Активность одной Международной единицы фактора Соотвествует его количеству в одном мл обычной плазмы крови человека. Расчет необходимой дозы фактора VIII основывается на эмпирическом факте, согласно которому 1 ME фактора VIII на кг массы тела человека увеличивает активность фактора VIII в плазме крови на 1,5 % - 2 % обычной активности.
Требуемая доза определяется по следующей формуле: .
Требуемое кол-во единиц = масса тела (кг) х желаемый уровень повышения фактора VIII (%) х (обратно пропорционально наблюдаемому восстановлению)
Объем вводимого препарата и кратность введения всегда должны быть соотнесены с клинической эффективностью в каждом отдельно взятом случае.
В случае следующих геморрагических явлений активность фактора VIII не должна падать ниже принятого уровня активности в плазме крови (в % от обычной активности) в соответствующем периоде.
В течение курса лечения рекомендуется определять активность фактора VIII для коррекции дозы препарата и кратности его «ведения. В случае радикального хирургическго вмешательства, обязательным является тщательный мониторинг заместительной терапии посредством коагуляционного анализа (активности фактора VIII в плазме крови). Пациенты могут иметь различный ответ на введение фактора VIII, который проявляется in vivo в разной степени высвобождения фактора VIII и в разном периоде его полувыведения.
Для долговременной профилактики кровотечений у пациентов с гемофилией А тяжелой степени обычная дозировка фактора VIII на кг массы тела составляет от 20 ME до 40 ME с интервалами по 2-3 суток. В некоторых случаях, особенно у молодых пациентов, могут быть необходимы более короткие интервалы или более высокие дозы.
Пациенты должны наблюдаться на предмет появления ингибиторов фактора VIII. Если ожидаемое повышение активности фактора VIII в плазме крови не достигается, или кровотечение не удается контролировать соответствующей дозой, необходимо провести исследование на наличие ингибиторов фактора VIII. У пациентов с высоким уровнем ингибитора терапия с применением фактора VIII может оказаться недейственной, вследствие чего необходимо рассмотреть иные варианты терапии. Лечением таких пациентов должны заниматься врачи, имеющие опыт работы с больными гемофилией.
Приготовить раствор препарата согласно Инструкции.
Препарат вводится внутривенно посредством инъекции или медленной инфузии.
При внутривенном введении рекомендуется наблюдать время введения 3-5 минут, измеряя пульс у пациентов и прекращая введение или уменьшая скорость введения при повышении пульса.
Скорость введения должна рассчитываться для каждого конкретного пациента.
Инструкция по применению
Восстановление порошка:
1. нагреть растворитель на водяной бане при температуре не выше 37 °С;
2. удалить защитные прижимные колпачки с флаконов с порошком и растворителем;
3. очистить спиртом поверхности флаконов, с которыми контактировали колпачки;
4. вставить двойную иглу во флакон с растворителем с волнистой стороны;
5. удалить колпачок с другой стороны двойной иглы, стараясь не прикасаться ко второй игле;
6. перевернуть флакон с растворителем вверх дном со вставленной в него двойной иглой, а вторую иглу вставить во флакон с порошком; при прокалывании пробки флакона с порошком конец иглы во флаконе с растворителем должен быть погружен в жидкость, а не находиться в воздухе; для предотвращения пенообразования растворитель необходимо медленно переливать по стенке флакона с лиофилизированным препаратом.
7. осторожно встряхивать до полного растворения;
8. извлечь ампулу с растворителем при помощи двойной иглы;
9. надеть на шприц фильтровальную иглу и набрать восстановленный концентрат;
10. заменить фильтровальную иглу «иглой-бабочкой» и произвести внутривенную инфузию.
Время восстановления — менее 3 минут.
Раствор должен быть прозрачным или слегка опалесцирующим.
Препарат может содержать мелкие хлопья или частички после восстановления.
Препарат необходимо визуально проверить перед введением. Не использовать мутные растворы и растворы с осадком.
После восстановления препарат должен быть использован немедленно.
Содержимое флакона должно быть использовано за один раз.
Неиспользованный раствор и отходы должны утилизироваться в соответствии с местными требованиями.
Передозировка
Сообщений о симптомах передозировки концентратом фактора свертывания крови VIII нет.
НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
У пациентов редко наблюдались признаки аллергических реакций (отек Квинке, жжение и покалывание в месте введения, озноб, гиперемия, генерализованная аллергическая сыпь, головная боль, крапивница, гипотензия, сонливость, тошнота, возбужденное состояние, тахикардия, затрудненность дыхания, звон в ушах, рвота, свистящее дыхание). В некоторых случаях подобные реакции прогрессировали до анафилаксии тяжелой степени (включая шок).
В редких случаях отмечалась лихорадка.
У пациентов с гемофилией А образуются нейтрализующие антитела (ингибиторы) к фактору VIII. При наличии подобных ингибиторов состояние пациента будет оцениваться как неэффективный клинический ответ. В таких случаях рекомендуется обращаться в специализированные центры гемофилии.
При беременности и кормлении
Исследования репродукции у животных при применении фактора VIII не проводились. По причине редких случаев гемофилии А у женщин данных о применении фактора VIII во время беременности и лактации нет. Поэтому фактор свертывания крови VIII во время беременности и в период лактации следует применять только в случаях, когда для этого имеются показания.
Форма выпуска
СОСТАВ:
Активное вещество:
фактор свертывания крови VIII - 500 МЕ/ампула, фактор свертывания крови VIII, восстановленный для инфузии при помощи воды - 50 МЕ/мл (500 МЕ/10 мл). объем растворителя - 10 мл.
Вспомогательные вещества: Трехосновной натрия цитрат, натрия хлорид, глицин, кальция хлорид, вода для инъекций.
Описание: Лиофилизат белого или светло-желтого цвета; приготовленный раствор прозрачный или слегка опалесцирующий, бесцветный или светло-желтого цвета.
Похожие препараты ЭМОКЛОТ лиофилизат 1000ме N1




Свойства ЭМОКЛОТ лиофилизат 1000ме N1
1
