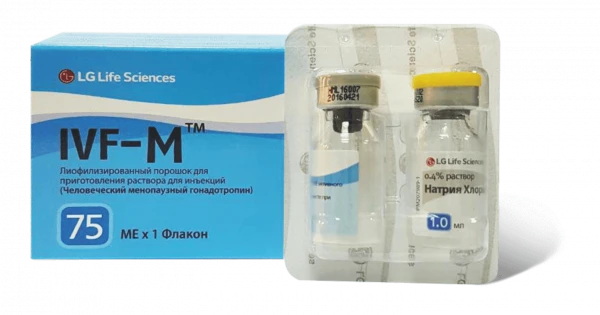
IVF M порошок 75ме N1
Гормон гипофиза, гипоталамуса и его аналог
Инструкция IVF M порошок 75ме N1
Особенности продажи
По рецепту
Состав и форма выпуска
Лекарственная форма: лиофилизированный порошок для приготовления раствора для инъекций.
Состав:
Один флакон препарата содержит:
активное вещество: менотропин 75 МЕ (150 МЕ);
вспомогательные вещества: D-маннитол, двухосновный натрия фосфат, одноосновный натрия фосфат;
флакон с растворителем: 0,4% раствор натрия хлорида для инъекций – 1,0 мл.
Фармакодинамика
Увеличивает уровень половых гормонов в плазме крови. У женщин стимулирует созревание фолликулов в яичниках (до предовуляторной стадии), повышает уровень эстрогенов, активирует пролиферацию эндометрия; у мужчин воздействует на клетки Сертоли семенных канальцев и индуцирует сперматогенез. Усиливает выработку стероидных гормонов половыми железами. Эффективность в основном обусловлена действием ФСГ.
Сmax ФСГ достигается через 6-24 часов после в/м введения. Т1/2 – 4-12.
Фармакокинетика
Биодоступность менотропина выше после подкожного введения, чем после внутримышечного введения. После внутримышечного введения 300 МЕ ФСГ и 300 МЕ ЛГ время достижения (ТСmax) максимальной концентрации (Cmax) в крови составило 18 ч, Cmax 4,15 мМЕ/мл, значение площади под кривой соотношения «концентрация-время» (AUC0-∞) 320,1 мМЕ/мл˖ч; после подкожного введения тСmax= 12 ч, Cmax = 5,62 мМЕ/мл, AUC0- = 385,2 мМЕ/мл˖ч.
Период полувыведения составляет 56 ч после внутримышечного введения и 51 ч после подкожного введения. Менотропин выводится преимущественно почками.
Фармакотерапевтическая группа
Гормон гипофиза, гипоталамуса и его аналог
Фармакологическое действие
IVF-М является препаратом менопаузного человеческого гонадотропина высокой степени очистки.
Препарат содержит фолликулостимулирующий и лютеинизирующий гормоны в соотношении 1:1, по 75Ме или 150 МЕ ФСГ и ЛГ, которые вырабатываются гипофизом человека.
Действующее вещество получают из мочи женщин в постклимактерическом периоде.
IVF-М у женщин вызывает повышение уровня эстрогенов в крови, рост и созревание фолликулов яичника.
Лекарственная форма
Флакон: боросиликатное стекло типа I,
Пробка: Хлоробутиловый эластомер;
Алюминиевый колпачок: алюминиевый колпачок/полипропиленовая открывающаяся крышка.
Побочные действия
У женщин могут наблюдаться в редких случаях: местная реакция при инъекции, лихорадка, артралгия.
У мужчин объединенная терапия IVF-М™ и IVF-C™ может вызвать гинекомастию.
Циркулирующая система: мозговой тромбоз.
Особые указания
Препарат IVF-M™ следует использовать только по назначению врача.
Женщины
Препарат IVF-M™ не следует применять в случаях, когда не может быть получен эффективный клинический ответ, например:
- дисгенез яичников;
- отсутствие матки;
- преждевременная менопауза;
- закупорка маточных труб.
Соответствующее лечение гипотиреоза, адренокортикальной недостаточности, гиперпролактинемии или гипофизарной опухоли должно быть проведено до терапии менотропином. Анализ спермы должен быть проведен перед началом терапии препаратом IVF. Возможность гиперстимуляции яичников может быть минимизирована, при введении рекомендуемой дозировки препарата и контроле терапии.
Чрезмерные эстрогенные ответы на препарат IVF-М™ обычно не вызывают существенные побочные эффекты, если препарат IVF-C™ (HCG) вводится параллельно с целью стимулирования овуляции.
Введение препаратов IVF-М™ и IVF-C™ нужно прекратить в случае высокого эстрогенного ответа на них. Уровень множественных беременностей после терапии IVF-М™ и IVF-C™ составляет 10 % и 40 %.
Частота прерывания беременности абортом была выше чем у нормальной популяции, но сопоставима с данным показателем у женщин, имеющих другие проблемы фертильности. Частота врожденных отклонений не увеличивалась при терапии препаратом IVF-М™.
Мужчины
Так как повышенные уровни ФСГ у мужчин являются показателем тестикулярной недостаточности, такие пациенты нечувствительны к IVF-М™ и IVF-C™.
Беременность
Связь между введением ЛГ и рождением детей с врожденными аномалиями до настоящего времени не установлена.
Но согласно эпидемиологическому отчету, была значительная разница между женщинами, которые родили детей с врожденными дефектами в сердце и конечностях и контрольной группой, в частоте ЛГ и применения ЛГ/ФСГ на ранней стадии беременности. Также сообщалось, что введение IVF-М™ было связано с маскуляцией внешних гениталий в женском зародыше и гипоспадией в мужском зародыше. Поэтому препарат должен использоваться только при врачебном контроле, после определения пользы терапии и риска, в течение первых 4 месяцев беременности.
Препарат следует хранить в не доступном для детей месте и не применять после истечения срока годности.
Показания
Женщины: основная и вторичная аменорея, гипоменорея, ановуляторная менструация. Аменорея после родов, включая синдром Chiari-Frommel или Sheeham (гипофизарный некроз после родов), синдром Argons-Castille (аменорреальная галакторея).
Мужчины: олигоспермия, азооспермия, гипогонадизм, эвнухоидизм.
Противопоказания
- Высокие уровни фолликуло-стимулирующего гормона (ФСГ), отражающие первичную недостаточность яичников.
- Неконтролируемая недостаточность щитовидной железы и надпочечников.
- Органические внутричерепные повреждения, такие как опухоль гипофиза.
- Любые случаи бесплодия, кроме ановуляции, как указано в показаниях.
- Абнормальное вагинальное кровотечение неустановленной причины.
- Киста яичника или увеличение не при поликистозном синдроме яичников.
- Первичная гиперчувствительность к менотропинам.
Лекарственное взаимодействие
В случае, если препарат IVF-М™ назначается, чтобы вызвать овуляцию, в комбинации или после применения гормона, стимулирующего функции яичников, может развиться сильная реакция, такая как синдром Meigs, сопровождаемая опухолью яичников, разрывом распухшего яичника, асцитом, гидротораксом, и кроме того, может развиться тромбоз, мозговой инфаркт вследствие увеличения концентрации гормона в крови или увеличения свертывания крови.
Дозировка
Рекомендуемый путь введения
Внутримышечный (в/м) или подкожный (п/к)
Рекомендуемая дозировка
График A:
75 МЕ или 150 МЕ менотропина/ день (IVF-М™) внутримышечно или подкожно
в течение 10 дней или до начала кровотечения фолликула Graafian согласно тесту активации фолликула.
Следует проводить экспертизу влагалища и цервикальной слизи каждый день или через день и при остановке терапии, когда следующие показатели указывают на полное созревание фолликула.
- экспертиза влагалища: эозинофильный индекс
- экспертиза цервикальной слизи: Ferntest & Shinnbarkeit
График В:
75 МЕ менотропина/ день (IVF-М™) внутримышечно или подкожно в течение первых 4 дней. Следует провести экспертизу вагинальной слизистой оболочки или цервикальной слизи. Если активность фолликул увеличивается с 4-ого дня терапии, продолжить лечение до максимальной фолликулярной активности (см. график A) и затем ввести человеческий хорионический гонадотропин (IVF-C™). Если необходимый клинический ответ не наблюдается, следует увеличить дозу IVF-М™ до 150 МЕ/день в течение первых 4 дней. 2500 МЕ HCG (IVF-C™) рекомендуется вводить в течение 3 дней через 24∼48 часов после введения последней дозы IVF-М™. Если пациентка хочет забеременеть, ей рекомендуется иметь половой акт во время периода введения HCG (IVF-C™).
График А следует рекомендовать как тест чувствительности для отдельного пациента на гонадотропин.
График B экономичен, но фолликулярный ответ должен быть тщательно проверен.
Указания по использованию
Приготовление для введения: 1 флакон менотропина следует растворить в 1 мл 0,4% стерильного раствора натрия хлорида, входящего в комплект с препаратом, и сразу же ввести внутримышечно (в/м) или подкожно (п/к). Приготовленный раствор может терять активность при стоянии. Оставшийся раствор использовать не следует.
Передозировка
Возможно развитие синдрома гиперстимуляции яичников. Лечение симптоматическое.
В случае легкой степени гиперстимуляции (степень I), которая сопровождается незначительным увеличением яичников (размер яичников 5-7 см), избыточной секрецией стероидных гормонов и болью в животе, нет необходимости принимать специальные меры предосторожности. Необходимо проинформировать пациентку о причинах этого состояния и проводить за ней тщательное наблюдение.
При степени гиперстимуляции II с образованием кист яичников(размер яичников 8-10 см), которая сопровождается болью в животе, тошнотой и рвотой, необходимо провести тщательное клиническое обследование, а в случае высокого уровня гемоглобина возможно будет необходимо замещение циркулирующей крови с помощью внутривенных вливаний.
При степени гиперстимуляции III с образованием больших кист яичников (размер яичников больше 10 см), которая сопровождается асцитом, гидротораксом, вздутием живота, болью в животе, диспноэ, задержкой соли в организме, повышением уровня гемоглобина, повышенной вязкостью крови, агрегацией тромбоцитов с риском тромбоэмболических осложнений необходима срочная госпитализация.
Форма выпуска
Форма выпуска и упаковка: По 75 МЕ или по 150 МЕ во флаконах в бесцветные стеклянные флаконы с резиновой пробкой, обжатые алюминиевыми колпачками, с предохранительной крышкой из пластмассы FLIP-OFF.
По 1 мл растворителя в бесцветных стеклянных флаконах с резиновой пробкой.
1 или 3 флакона с препаратом и 1 или 3 флакона с растворителем помещают в ячейковую упаковку и вместе с инструкцией по применению на государственном и русском языках вкладывают в картонную коробку.
СОСТАВ:
Один флакон содержит:
Активное вещество - менотропин- 75 МЕ или 150 МЕ,
Вспомогательные вещества: D-маннитол, натрия гидрофосфат, натрия дигидрофосфата моногидрат.
1 флакон с растворителем содержит: натрия хлорид, вода для инъекций.
Описание: Лиофилизированная масса белого или желтовато-белого цвета.
Растворитель: прозрачный бесцветный раствор.
Похожие препараты IVF M порошок 75ме N1