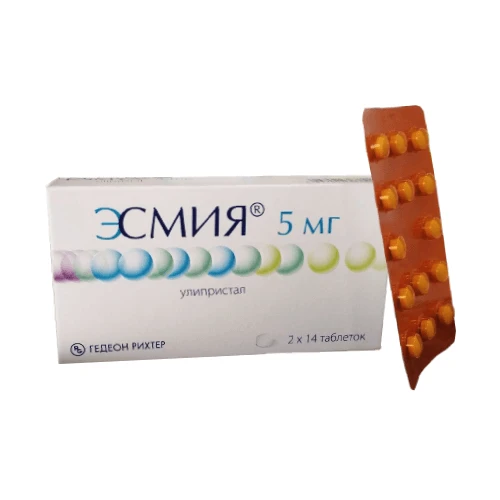
Эсмия
Формы выпуска Эсмия
Цена
от 1 423 000 сум
- Инструкция к применению препарата Эсмия
- Состав препарата Эсмия
- Показания и противопоказания препарата Эсмия
- Цена на Эсмия в аптеках Ташкента
Инструкция Эсмия
Фармакотерапевтическая группа
Средство, преимущественно применяемое в акушерстве и гинекологии
Cтрана происхождения
Венгрия
Категория
Активное вещество
Показания к применению
- для предоперационной терапии умеренных и тяжелых симптомов миомы матки у взрослых женщин детородного возраста. Длительность лечения ограничена 3 месяцами.
Противопоказания
- — кровотечение из влагалища неясной этиологии или по причинам, не связанным с миомой матки; — рак матки, шейки матки, яичников или молочной железы; — продолжительность терапии свыше 3 месяцев (в связи с отсутствием данных по безопасности при более длительном применении); — беременность и период лактации; — повышенная чувствительность к улипристала ацетату или любому из вспомогательных веществ. С осторожностью следует назначать препарат при почечной и/или печеночной недостаточности, бронхиальной астме.
Состав
- Улипристал 5мг; Вспомогательные в-ва: МКЦ, маннитол, тальк, кроскармеллоза натрия, магния стеарат
Фармакокинетика
Всасывание После однократного приема внутрь в дозе 5 мг или 10 мг улипристала ацетат быстро всасывается, достигая примерно через 1 ч после приема Cmax 23.5±14.2 нг/мл и 50.0±34.4 нг/мл, соответственно. AUC0-? составляет 61.3±31.7 и 134.0±83.8 нг?ч/мл, соответственно. Улипристала ацетат быстро трансформируется в фармакологически активный метаболит, при этом через 1 ч после приема Cmax составляет 9.0±4.4 нг/мл и 20.6±10.9 нг/мл, AUC0-? - 26.0±12.0 и 63.6 ± 30.1 нг?ч/мл, соответственно. Прием улипристала ацетата в дозе 30 мг вместе с завтраком с высоким содержанием жиров приводит к снижению средней Cmax примерно на 45%, удлинению времени достижения Cmax (от медианы 0.75 ч до 3 ч) и 25% повышению AUC0-?, по сравнению с приемом натощак. Такие же результаты получены для активного моно-N-деметилированного метаболита. Этот кинетический эффект пищи не расценивается как значимый для ежедневного приема таблеток улипристала ацетата. Распределение Улипристала ацетат в высокой степени (> 98%) связывается с белками плазмы, включая альбумин, ?1-кислый гликопротеин, липопротеин высокой плотности и липопротеин низкой плотности. Метаболизм Улипристала ацетат быстро превращается в моно-N-деметилированный и затем в ди-N-деметилированный метаболиты. Данные in vitro показывают, что этот процесс происходит в системе цитохрома P450 с участием изофермента 3A4 (CYP3A4). Исходя из того, что метаболизм улипристала ацетата опосредован цитохромом P450, ожидается влияние печеночной недостаточности на выведение улипристала ацетата, что приведет к увеличению его воздействия. Выведение Основной путь выведения – через кишечник, менее 10% вещества выводится почками. Конечный T1/2 улипристала ацетата после однократного приема 5 мг или 10 мг составляет примерно 38 ч, средний клиренс около 100 л/ч. Данные in vitro показывают, что в клинически значимых концентрациях улипристала ацетат и его активный метаболит не ингибируют изоферменты CYP1A2, 2A6, 2C9, 2C19, 2D6, 2E1 и 3A4 и не индуцируют изофермент CYP1A2. Таким образом, применение улипристала ацетата не должно влиять на клиренс лекарственных препаратов, которые метаболизируются при участии данных изоферментов. Данные in vitro показывают, что улипристала ацетат и его активный метаболит не являются субстратами P-гликопротеина (ABCB1).
Фармакологическое действие
Улипристала ацетат – активный при приеме внутрь синтетический селективный модулятор прогестероновых рецепторов, характеризующийся тканеспецифичным частичным антипрогестероновым эффектом. Эндометрий Улипристала ацетат оказывает прямое действие на эндометрий. При начале ежедневного приема препарата в дозе 5 мг в течение менструального цикла у большинства женщин (включая пациенток с миомой) заканчивается очередная менструация, а следующая не наступает до прекращения лечения. Когда прием препарата прекращается, менструальный цикл обычно возобновляется в течение 4 недель. Прямое действие на эндометрий приводит к специфичным для этого класса препаратов изменениям в эндометрии, связанным с модулятором рецепторов прогестерона (Progesterone Receptor Modulator Associated Endometrial Changes (PAEC)). Как правило, гистологические изменения представлены неактивным и слабо пролиферирующим эпителием, сопровождающимся асимметрией роста стромы и эпителия, выраженным кистозным расширением желез со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) влияниями на эпителий. Такие изменения отмечались примерно у 60% пациенток, получавших улипристала ацетат в течение 3 месяцев. Они обратимы и исчезают после прекращения лечения, их не следует принимать за гиперплазию эндометрия. Примерно у 5% пациенток детородного возраста с тяжелыми формами менструальных кровотечений толщина эндометрия больше 16 мм. У 10-15% пациенток, получающих улипристала ацетат, эндометрий может утолщаться (>16 мм) в ходе лечения. Это утолщение исчезает после прекращения приема препарата и возобновления менструальных кровотечений. Если утолщение эндометрия остается в течение 3 месяцев после окончания лечения и восстановления менструаций, следует провести дополнительное обследование для исключения других заболеваний. Лейомиома Улипристала ацетат оказывает прямое действие на лейомиомы, подавляя клеточную пролиферацию и индуцируя апоптоз, что приводит к уменьшению их размеров. Гипофиз При ежедневном приеме улипристала ацетата в дозе 5 мг происходит подавление овуляции у большинства пациенток, о чем свидетельствует поддержание концентрации прогестерона на уровне около 0.3 нг/мл. При ежедневном приеме улипристала ацетата в дозе 5 мг частично снижается концентрация фолликулостимулирующего гормона (ФСГ), однако концентрация эстрадиола в сыворотке крови у большинства пациенток поддерживается на уровне средней фолликулярной фазы и соответствует таковой в группе плацебо. Улипристала ацетат не влияет на концентрацию тироксинсвязывающего глобулина (ТСГ), адренокортикотропногогормона(АКТГ) и пролактина в сыворотке крови на протяжении 3 месяцев лечения. Клиническая эффективность и безопасность Эффективность фиксированных доз улипристала ацетата 5 мг и 10 мг 1 раз/, оценивалась в двух рандомизированных двойных слепых 13-недельных исследованиях III фазы, в которые были включены пациентки с тяжелым обильным менструальным кровотечением, связанным с лейомиомой матки. Исследование 1 было двойным слепым и плацебо-контролируемым. В него были включены пациентки с анемией (Hb 100 в течение первых 8 дней менструации считается признаком повышенной менструальной кровопотери. В исследовании 1 статистически значимые различия наблюдались в показателях снижения менструальной кровопотери в пользу улипристала ацетата по сравнению с плацебо (см. таблицу 1), что обеспечивает более быструю и эффективную коррекцию анемии по сравнению с монотерапией препаратами железа. Аналогичным образом, у пациенток, получавших улипристала ацетат, отмечалось более выраженное уменьшение размеров миомы, что было доказано с помощью МРТ. В исследовании 2 уменьшение менструальной кровопотери было сравнимым для групп пациенток, получавших улипристала ацетат и агонист ГнРГ (лейпрорелин). У большинства пациенток, получавших улипристала ацетат, кровотечение прекратилось в течение первой недели лечения.
Побочные эффекты
- Безопасность улипристала ацетата оценивалась у 393 женщин с миомами матки, получавших 5 мг или 10 мг улипристала ацетата в ходе исследований III фазы. Наиболее частым наблюдаемым явлением в клинических исследованиях была аменорея (82.2%), которая считается желаемым исходом. Наиболее частой побочной реакцией было появление приливов. Подавляющее большинство побочных реакций были легкими или умеренными (94.9%), не приводили к прекращению лечения препаратом (99.3%) и разрешались самостоятельно. В ходе двух исследований III фазы у пациенток с миомами матки, получавших препарат в течение 3 месяцев, сообщалось о следующих побочных реакциях. Неблагоприятные побочные реакции представлены по системно-органным классам в соответствии с классификацией MedDRA и с частотой возникновения: очень часто (? 1/10); часто (от ? 1/100 до
Дозировка
- 5 мг
Описание лекарственной формы
- Таблетки
Особые условия хранения
Улипристала ацетат назначается только после тщательного обследования. До начала лечения следует исключить беременность. Контрацепция В связи с возможностью нежелательных взаимодействий сопутствующее применение только гестагенсодержащих препаратов, гестаген-рилизинг систем или комбинированных пероральных контрацептивов не рекомендуется. Хотя у большинства женщин, получавших терапевтические дозы улипристала ацетата, наблюдалась ановуляция, рекомендовано дополнительное использование негормонального метода контрацепции в ходе лечения. Почечная недостаточность Нет оснований предполагать, что почечная недостаточность может значительно влиять на выведение улипристала ацетата. Не рекомендуется применять улипристала ацетат без постоянного наблюдения у пациенток с тяжелой почечной недостаточностью, так как специальные исследования не проводились. Печеночная недостаточность Отсутствует опыт терапевтического применения улипристала ацетата у пациенток с печеночной недостаточностью. Ожидается, что печеночная недостаточность может влиять на выведение улипристала ацетата, что приведет к увеличению воздействия препарата. Это несущественно для пациенток с печеночной недостаточностью легкой степени. Не рекомендуется назначать улипристала ацетат пациенткам с умеренной или тяжелой печеночной недостаточностью при невозможности постоянного наблюдения. Сопутствующая терапия Улипристала ацетат не рекомендован для применения пациенткам, получающим субстраты P-gp (дабигатран этексилат, дигоксин). Одновременное применение умеренных или мощных ингибиторов изофермента CYP3A4 и улипристала ацетата не рекомендуется. Одновременное применение улипристала ацетата и мощных индукторов изофермента CYP3A4 (рифампицин, карбамазепин, фенитоин, препараты зверобоя продырявленного) не рекомендуется. Бронхиальная астма Не рекомендуется применение препарата у женщин с тяжелой формой бронхиальной астмы, не поддающейся коррекции пероральными ГКС. Изменения эндометрия Улипристала ацетат оказывает специфическое фармакодинамическое действие на эндометрий. Может отмечаться увеличение толщины эндометрия. Если утолщение эндометрия сохраняется в течение 3 месяцев после окончания лечения и возобновления менструаций, следует провести дополнительное обследование для исключения других заболеваний. У пациенток, получающих улипристала ацетат, при гистологическом исследовании могут наблюдаться изменения строения эндометрия. Такие изменения обратимы после завершения лечения. Эти гистологические изменения обозначаются как изменения в эндометрии, связанные с модулятором рецепторов прогестерона (PAEC), и они не должны быть ошибочно оценены как гиперплазия эндометрия. В связи с отсутствием данных по безопасности длительного применения препарата (более 3 месяцев) или повторных курсов лечения риск неблагоприятного воздействия на эндометрий в случае продолжения лечения неизвестен. Поэтому длительность лечения не должна превышать 3 месяца.
Лекарственное взаимодействие
Возможное влияние других лекарственных препаратов на действие улипристала ацетата: Гормональные контрацептивы Улипристала ацетат обладает стероидной структурой и действует как селективный модулятор прогестероновых рецепторов с преобладающим ингибирующим эффектом в отношении прогестероновых рецепторов. Таким образом, гормональные контрацептивы и гестагены могут снижать эффективность улипристала ацетата путем конкурентного воздействия на прогестероновый рецептор. Поэтому не рекомендуется одновременное применение препаратов, содержащих гестагены. Ингибиторы изофермента CYP3A4 После применения умеренного ингибитора изофермента CYP3A4 эритромицина пропионата (500 мг 2 в течение 9 дней) у здоровых женщин-добровольцев показатели Cmax и AUC улипристала ацетата повышались в 1.2 и 2.9 раза, соответственно; величина AUC активного метаболита улипристала ацетата повышалась в 1.5 раза, в то время как Cmax активного метаболита снижалась (в 0.52 раза).
Внимание: описание препарата на данной странице является упрощенной и дополненной версией официальной инструкции. Информация предоставлена исключительно в ознакомительных целях и не должна использоваться как руководство к самолечению. Перед приемом препарата Эсмия обязательно проконсультируйтесь с врачом
Цены Эсмия
Аптеки
Адрес
Режим работы
Купить
Аптека: CITY PHARM А-21 - АХМАД ДОНИШ
Юнусабадский район, 13-квартал, 3-дом
Круглостуочно
1 517 000 сум
ЗабронироватьАптека: CITY PHARM А-27 - КАРДИОЛОГИЯ/1
Мирзо-Улугбекский район, ул. Осиё, 17-дом
Круглостуочно
1 517 000 сум
ЗабронироватьАптека: Europharm
Мирзо-Улугбекский район, квартал Буюк Ипак Йули, 26 дом, 13 кв
Пн, Вт, Ср, Чт, Пт, Сб, Вс | 08:00-23:00
1 600 000 сум
ЗаказатьАптека: Гет Фарма Гудс
Мирзо-Улугбекский район, ул. Феруза 1/3
Круглостуочно
1 423 000 сум
Все фото Эсмия

Обсуждения Эсмия
Отзывы Эсмия
Рейтинг 4.4 на основе 7 отзывов
Севзора
22.07.2021 14:31
5
Еще не так давно считалось, что избавиться от миомы можно только оперативным путем. Девочки могу вас обрадовать, проверила на себе. Препарат Эсмия – отличная альтернатива. Из побочных эффектов я обнаружила на себе только небольшой набор веса. Цена хорошая, да и купить можно в любой аптеке. Два курса попила и миома уменьшилась, надеюсь, по жизни обойдусь без операции.
Донохон
01.08.2019 22:53
4
Менструация стала очень обильной и болезненной, не понимала в чем проблема. Обратилась к своему гинекологу, миома 12-13 недель. Врач мне предложила два варианта решения проблемы: операция или препарат Эсмия. Естественно, второй вариант меня больше устраивал. Только переживала помогут или нет. Не хотелось зря выкидывать деньги, цена на лекарство не бюджетная. После первого курса миома уменьшилась в размерах, начала прием второго (жду с нетерпением узи). Сдвиг уж есть и это хорошо.
Дина
17.06.2021 12:57
5
Я стабильно раз в год прохожу обследование у гинеколога и была крайне расстроена, когда у меня обнаружили миому. Все было хорошо и на тебе. Врач назначила мне эсмия. Я «прошерстила» много сайтов, почитала отзывы, побочные эффекты. Я решилась и побежала в аптеку купить препарат. Цена адекватная. Пропила 3 курса, миома уменьшилась в два раза.
Забаржад
14.03.2020 04:11
5
Моя мама очень упертый человек. Заставить ее сходить в поликлинику очень сложно. А у нее уже давно были женские проблемы. Странные кровотечения и недомогания она сначала связывала с климаксом, однако вскоре ей стало очень плохо и я ей вызвала скорую помощь. Оказалось, что у мамы миома. При чем очень запущенная. Врачи сказали, что необходима операция. Для подготовки порекомендовали препарат Эсмия. Конечно же я купила его (продается только по рецепту!), ведь в мамином случае необходимо было максимально обезопаситься перед оперативным вмешательством. Лекарство мама переносила хорошо, никаких побочных эффектов, кровотечения и боли прекратились. После курса таблеток УЗИ показало, что ситуация заметно улучшилась. Операция прошла хорошо, выздоровление идет полным ходом.
Фарида
08.10.2020 00:01
4
Множественные узлы и миома в 9-10 недель как то меня совсем не обрадовали. Гинеколог сказала, что если купить препарат эсмия, можно обойтись без хирургического вмешательства. Я решила почитать отзывы в интернете, ведь цена не маленькая. Много хвалебных, поэтому я решилась. Повторное обследование и результат – существенное уменьшение миомы. Единственный минус – чуть поднабрала в весе (может просто много ем).
Ойимхол
04.12.2020 02:54
4
Мы с сестрой двойняшки. Сейчас нам по 36 лет. У сестры полгода назад обнаружили миому матки. Я просто решила обследоваться за компанию и оказалось что и у меня миома! Хотя симптомов никаких не замечали ни она, ни я. Лечение начали вместе у одного врача. Назначили нам лекарство Эсмия. Врач нам сказал, хоть цена его и высока, но и эффект не заставит себя ждать. Приобрели в аптеке по рецепту. Я очень тяжело переносила этот препарат. Меня постоянно тошнило, кружилась голова, в туалет по-маленькому бегала очень часто. А вот у сестры было все супер. На нее препарат действовал так как надо. Самочувствие было хорошим, ни на что не жаловалась. Хотя мы двойняшки, но вот такая была разная реакция. В итоге, после курса этих таблеток, опухоль уменьшилась и у нее, и у меня. Поэтому препарат однозначно эффективен, но вот побочные эффекты могут доставить неудобства.
Калира
01.11.2019 17:43
4
У моей мамы миома матки. Она у нее уже несколько лет. Врачи прописывали ей различные препараты, предотвращающие рост опухоли и все нормально было. Но в прошлом году зафиксировали увеличение опухоли. Маме сообщили, что операции не избежать. Для того, чтобы операция прошла успешно, необходимо было минимизировать риски. Врач выписал рецепт на препарат Эсмия. Три месяца мама сидела на этом препарате. Стоит лекарство очень дорого. Зато эффект был очень хороший, по УЗИ опухоль уменьшилась и приобрела четкие очертания, что позволило удалить ее впоследствии без осложнений. Эсмия - дорогой препарат, но реально помогает при подготовке к операциям по удалению миомы.