Фейба
Инструкция Фейба
Гемостатик
Противопоказания
Если нет ответа на лечение с подходящей концентрацией фактора коагуляции крови (например, в случае высокого титра ингибитора), препарат Фейба может применяться при:
аллергии к любому веществу препарата;
диссеминированном внутрисосудистом свертывании (ДВС синдром), опасном для жизни состоянии с обширным свертыванием крови кровеносных сосудах и выраженным образованием тромбов, что приводит к расходу факторов свертывания в
организме;
инфаркте миокарда, остром тромбозе и/или эмболии только при угрожающих жизни кровотечениях.
Фармакологическое действие
Препарат Фейба производиться из человеческой плазмы. Препарат применяется для лечения кровотечений, когда отдельные факторы свертывания снижены или отсутствуют.
Дозировка
Лечение должно начинаться и проводиться под контролем врача, имеющего опыт лечения нарушений коагуляции.
ДозыДоза и продолжительность лечения определяется врачом в зависимости от тяжести нарушения свертываемости крови, локализации и интенсивности кровотечения, а также клинического состояния пациента. При выборе дозы и частоты введения следует руководствоваться клинической эффективностью в каждом индивидуальном случае.
Как правило, рекомендуется вводить препарат в дозе от 50 до 100 единиц на кг массы тела. При этом не следует превышать разовую дозу - 100 ЕД/кг массы тела и суточную дозу – 200 ЕД/кг массы тела, если только тяжесть кровотечения оправдывает и объясняет применение высоких доз.
Не допускается изменение дозировки, определенной врачом, и прекращение использования препарата самостоятельно. Необходимо сообщить врачу, если эффект
препарата Фейба слишком сильный или слабый.
Из-за специфических для пациента факторов реакция на антиингибиторный коагулянтный комплекс может варьироваться, и в отдельном случае кровотечения пациенты, неадекватно реагирующие на одно вещество, могут хорошо реагировать на другое вещество. В случае недостаточной реакции на антиингибиторный коагулянтный комплекс следует рассмотреть возможность использования другого вещества.
Педиатрическая популяция (дети)
Опыт применения препарата Фейба у детей младше 6 лет ограничен. Режим дозирования препарата остается таким же, как и у взрослых и должен быть адаптирован согласно клиническому состоянию ребенка.
-
Спонтанные кровотечения
Кровоизлияния в суставы, мышцы и мягкие ткани
В случаях кровотечений малой и средней интенсивности рекомендуются дозы препарата Фейба от 50 до 75 ЕД/кг массы тела каждые 12 часов. Лечение необходимо продолжать до получения четких признаков клинического улучшения: исчезновения боли, восстановления подвижности сустава, уменьшения его объема.
В случаях обширных кровоизлияний в мышцы и мягкие ткани, например, при забрюшинных гематомах, рекомендуемая доза составляет 100 ЕД/кг массы тела каждые 12 часов.
Кровотечения из слизистых оболочек
Рекомендуется доза 50 ЕД/кг массы тела каждые 6 часов при тщательном наблюдении за пациентом (состояние области кровотечения, динамика гематокрита). Если кровотечение не прекращается, разовую дозу можно увеличить до 100 ЕД/кг массы тела, но при этом не превышать максимальную суточную дозу 200 ЕД/кг массы тела.
Другие тяжелые кровотечения
Тяжелые геморрагии, такие как кровоизлияния в ЦНС, эффективно купируются путем введения препарата в разовой дозе 100 ЕД/кг массы тела каждые 12 часов. В отдельных случаях препарат Фейба можно вводить с 6-часовым интервалом до достижения отчетливого клинического улучшения, но, не превышая максимальную суточную дозу в 200 ЕД/кг массы тела.
-
Хирургические вмешательства
При хирургических вмешательствах начальную дозу 100 ЕД/кг массы тела можно ввести до операции и дополнительные 50 - 100 ЕД/кг массы тела можно ввести через 6-12 часов. В качестве послеоперационной поддерживающей дозы можно ввести 50 - 100 ЕД/кг массы тела с интервалом 6-12 часов. Дозировка, интервалы введения доз, продолжительность лечения во время и после операции зависят от оперативного вмешательства, общего состояния пациента и клинической эффективности в каждом конкретном случае. (Максимальная суточная доза 200 ЕД/кг массы тела не должна превышаться!)
-
Профилактика кровотечений у пациентов с ингибиторной формой гемофилии А
Профилактика кровотечений у пациентов с ингибиторами и частыми кровотечениями после неудачной индукции иммунной толерантности (ИИТ) или, когда ИИТ не подходит:
Рекомендуемая доза составляет 70-100 ЕД/кг массы тела через день. Если необходимо, доза может быть увеличена до 100 ЕД/кг массы тела в день или может быть постепенно снижена.
Профилактика кровотечений у пациентов с высоким титром ингибитора во время проведения индукции иммунной толерантности (ИИТ) и частыми кровотечениями
Препарат Фейба может назначаться одновременно с фактором VIII в интервале доз 50-100 ЕД/кг массы тела два раза в сутки, пока титр ингибитора не уменьшится до <2 БЕ*.
* 1 БЕ (единица Бетезда) определяется как количество антител, которое ингибирует 50% активности фактора VIII в свежей стандартной человеческой плазме после инкубации в течение 2 ч. при +37°С.
Мониторинг
В случае недостаточного ответа на лечение препаратом рекомендуется определить количество тромбоцитов, так как достаточное количество функционально интактных тромбоцитов считается необходимым для эффективности применения препарата.
Из-за сложного механизма действия прямой контроль активных веществ невозможен. Коагуляционные тесты, такие как время свертывания цельной крови, тромбоэластограмма и активированное частичное тромбопластиновое время, обычно показывают незначительное сокращение соответствующих показателей и не коррелируют с клиническим улучшением. По этой причине указанные тесты имеют ограниченное значение для контроля терапии препаратом Фейба.
Способ применения
Приготовленный раствор Фейба вводится внутривенно медленно путем инъекции или инфузии со скоростью не более 2 ЕД/кг массы тела в минуту.
Раствор препарата готовится непосредственно перед введением. Раствор необходимо использовать немедленно после приготовления (препарат не содержит консервантов). Не следует использовать мутный раствор или раствор с включениями. Неиспользованный препарат и отходы должны быть соответствующим образом утилизированы.
Раствор необходимо тщательно перемешать и убедиться в полном растворении препарата, иначе через фильтр устройства пройдет меньше единиц.
Открытые упаковки повторному использованию не подлежат.
Для приготовления раствора используют только воду для инъекций и набор для растворения и введения, входящие в состав упаковки.
При использовании другого устройства необходимо убедиться в наличии подходящего фильтра с размером пор не менее 149 мкм.
Не использовать препарат, если нарушен стерильный барьер, упаковка повреждена или на ней имеются признаки порчи.
Приготовление раствора для инфузии
Используйте асептическую технику на протяжении всей процедуры.
-
Закрытый флакон с растворителем (водой для инъекций) нагреть до комнатной температуры или температуры не выше +37 ˚С, если необходимо, на водяной бане в течение нескольких минут.
-
Удалить защитные колпачки с флаконов с лиофилизатом и растворителем и продезинфицировать резиновые пробки на обоих флаконах. Поместить флаконы на плоскую поверхность.
-
Открыть упаковку с BAXJECT II Hi-Flow, удалив защитную пленку, не касаясь содержимого упаковки (Рис. A). Не извлекать устройство из упаковки.
-
Перевернуть упаковку и проткнуть концом прилагаемой иглы-переходника резиновую пробку флакона с растворителем (Рис. B). Потянуть за края упаковки, чтобы удалить ее с устройства BAXJECT II Hi-Flow (Рис. C). Не снимать синюю защиту с устройства BAXJECT II Hi-Flow.
-
Перевернуть всю систему с устройством BAXJECT II Hi-Flow на флаконе, чтобы флакон с препаратом оказался сверху. Концом прилагаемой иглы-переходника проткнуть резиновую пробку флакона с лиофилизатом. За счет вакуума растворитель перетечет во флакон с лиофилизатом (Рис. D).
-
Осторожно вращать флакон (не встряхивать) до полного растворения лиофилизата. Убедиться, что лиофилизат полностью растворился, иначе активное вещество может застрять в фильтре.

![]()
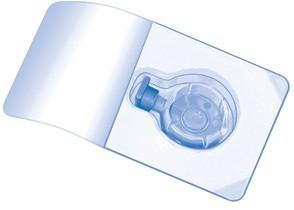
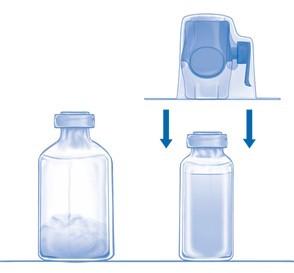 Рис. A Рис. B Рис. C Рис. D
Рис. A Рис. B Рис. C Рис. D
Инфузия
-
Удалить синюю защиту с устройства BAXJECT II Hi-Flow. Взять шприц и соединить его с устройством BAXJECT II Hi-Flow. НЕ НАБИРАТЬ В ШПРИЦ ВОЗДУХ (Рис. E). Рекомендуется использовать шприц Люера, чтобы обеспечить плотное соединение между шприцем и устройством BAXJECT II Hi-Flow (повернуть шприц по часовой стрелке до упора).
-
Перевернуть всю систему с устройством BAXJECT II Hi-Flow на флаконе, чтобы флакон с препаратом оказался сверху. МЕДЛЕННО набрать раствор в шприц, осторожно вытягивая поршень шприца и следя за тем, чтобы на протяжении всего процесса соединение между устройством BAXJECT II Hi Flow и шприцем было герметичным (Рис. F).
-
Разъединить шприц.
-
Если происходит пенообразование, подождать, пока пена не исчезнет. Медленно ввести раствор внутривенно с помощью прилагаемого инфузионного набора (или одноразовой канюли).
Рис. E Рис. F
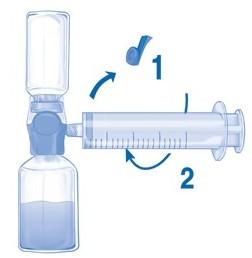
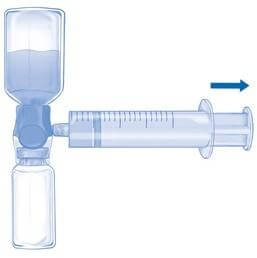
Скорость введения приготовленного раствора не должна превышать 2 ЕД/кг массы тела/мин.
Передозировка
При приеме излишнего количества препарата Фейба необходимо немедленно сообщить лечащему врачу. Высокие дозы препарата увеличивают риск развития тромбоэмболических осложнений (образования сгустков крови, которые попадают в кровеносные сосуды), коагулопатии потребления (выраженное образование тромбов в кровеносных сосудах, ДВС) или инфаркта миокарда. Часть зарегистрированных осложнений произошла при назначении препарата в дозах выше 200 единиц/кг массы тела или у пациентов с другими факторами развития тромбоэмболических осложнений. При симптомах тромботических и тромбоэмболических осложнений введение препарата следует немедленно прекратить и принять соответствующие диагностические и терапевтические меры.
Особые условия хранения
Перед использованием препарата Фейба необходимо проконсультироваться с врачом, поскольку данный препарат может вызывать реакции гиперчувствительности, такие как:
эритема (покраснение кожи);
сыпь;
бугорки по коже всего тела (крапивница);
зуд по всему телу;
отек губ и языка;
расстройства дыхания/одышка;
стеснение в груди;
общее недомогание;
головокружение;
пониженное артериальное давление.
Другие симптомы реакции гиперчувствительности к препаратам, полученным из плазмы, включают летаргию и беспокойство.
Необходимо немедленно прекратить инфузию и обратиться к врачу при возникновении любого из вышеописанных симптомов. Данные симптомы могут быть ранними признаками анафилактической реакции и требуют неотложной помощи.
При повторном применении препарата у пациентов с предполагаемой гиперчувствительностью к его компонентам необходимо провести оценку ожидаемой пользы и риска воздействия, включая возможность проведения профилактического лечения или применения альтернативных методов терапии.
При серьезных изменениях артериального давления или пульса, затрудненном дыхании, кашле или боли в груди, необходимо немедленно прекратить инфузию и обратиться к врачу.
У пациентов с ингибиторной формой гемофилии или приобретенными коагулопатиями вследствие ингибиторов к факторам свертывания при лечении препаратом Фейба может быть повышенная склонность к кровотечению и повышенный риск тромбозов.
Контроль в ходе лечения
Не следует превышать разовую дозу 100 ЕД/кг и суточную 200 ЕД/кг массы тела. За пациентами, получающими разовую дозу 100 ЕД/кг, следует проводить тщательное наблюдение на предмет возможного развития ДВС-синдрома и/или симптомов острой коронарной ишемии и других симптомов развития тромбозов или тромбоэмболических осложнений. Высокие дозы препарата Фейба должны назначаться только на время, необходимое для остановки кровотечения.
В случае появления клинически выраженных нарушений артериального давления и частоты пульса, затруднения дыхания, болей в грудной клетке и кашля, введение препарата необходимо немедленно прекратить и начать соответствующие диагностические и лечебные мероприятия. Важными лабораторными признаками ДВС- синдрома являются снижение фибриногена, уменьшение числа тромбоцитов и/или присутствие продуктов деградации фибрина/фибриногена (ПДФ). Другими признаками являются: значительное удлинение тромбинового времени, протромбинового времени или активированного частичного тромбопластинового времени (АЧТВ). У пациентов с ингибиторной гемофилией или с приобретенными ингибиторами к факторам VIII, IX и/или XI активированное частичное тромбопластиновое время (АЧТВ) продлевается сопутствующим заболеванием.
Прием препарата пациентами с ингибиторами может привести к первоначальному
«анамнестическому» увеличению уровня ингибиторов. При непрерывном использовании препарата Фейба ингибиторы могут снижаться в течение продолжительного времени. Клинические и опубликованные данные предполагают, что эффективность препарата Фейба не снижается.
У пациентов с ингибиторной гемофилией или с приобретенными ингибиторами к факторам коагуляции, которые лечились препаратом Фейба, может увеличиться склонность к кровотечениям, а также риск развития тромбозов.
Лабораторные анализы и клиническая эффективность
Результаты анализов, проводимых для контроля эффективности лечения in vitro, таких как активированное частичное тромбопластиновое время, время свертывания цельной крови и тромбоэластограмма, могут не коррелировать с клиническим улучшением. Поэтому попытки достичь нормализации этих показателей путем увеличения доз препарата Фейба могут быть не только неэффективными, но и повысить риск развития ДВС-синдрома в результате передозировки.
Тромбоз и тромбоэмболические осложнения, включая диссеминированное внутрисосудистое свертывание (ДВС синдром), венозный тромбоз, легочную эмболию, инфаркт миокарда, инсульт, могут развиться во время лечения препаратом Фейба. Сопутствующее лечение рекомбинантным фактором также увеличивает риск развития тромбоэмболического осложнения. Некоторые из указанных тромбоэмболических осложнений могут возникнуть на фоне увеличения дозы препарата.
Поскольку препарат производится из плазмы или крови человека, для предотвращения передачи инфекции пациентам принимаются особые меры, в частности, тщательный отбор доноров крови и плазмы для исключения носительства и лабораторный скрининг индивидуальных плазменных пулов на специфические маркеры вирусов и инфекций. Производители данных продуктов также используют этапы обработки крови и плазмы для инактивации или удаления вирусов. Несмотря на это, при применении лекарственной продукции из человеческой крови или плазмы, возможность передачи инфекционных
агентов не может исключаться полностью. Это также применимо к неизвестным или появляющимся вирусам и прочим патогенам.
Принятые меры считаются эффективными для оболочечных вирусов, таких как ВИЧ, гепатит В и гепатит С и для не оболочечных вирусов гепатита А. Принятые меры могут иметь ограниченное значение против не оболочечных вирусов, таких как парвовирус В19. Инфекция парвовирусом В19 может быть опасна для беременных женщин (инфицирование плода) и пациентов с иммунодефицитом или повышенным распадом эритроцитов (например, при гемолитической анемии).
Если вы регулярно или повторно получаете терапию препаратами ингибитора фактора VIII, изготовленными из человеческой плазмы, врач может порекомендовать вам вакцинацию против гепатитов А и В.
На фоне приема высоких доз препарата Фейба, транзиторное увеличение пассивно переходящих антител к поверхностному антигену гепатита В может привести к заблуждению толкования положительных результатов в серологическом тестировании.
Каждый раз при введении препарата Фейба настоятельно рекомендуется фиксировать название и номер серии препарата.
Содержание натрия
Фейба 500 ЕД содержит около 80 мг натрия на флакон.
Это следует учитывать для пациентов, придерживающихся диеты с низким содержанием натрия.
Беременность и период лактации
Перед назначением препарата Фейба при беременности и кормления грудью врач должен оценить соотношение риск/польза. Из-за повышенного риска тромбоза во время беременности препарат следует назначать только под пристальным наблюдением врача и только в случае крайней необходимости.
Влияние на способность управлять транспортными средствами или работу с механизмами
Влияние на способность управлять автомобилем или работу с механизмами не отмечено.
Лекарственное взаимодействие
Перед началом приема препарата Фейба необходимо сообщить врачу, если Вы принимаете или недавно принимали какие-либо лекарственные средства (в том числе не прописанные в данном разделе).
Нет достаточных или строго контролируемых исследований комплексного или последовательного применения препарата Фейба и рекомбинантного фактора VIIa или антифибринолитических средств. При использовании в комбинации с препаратом Фейба антифибринолитических средств типа транексамовой или аминокапроновой кислоты следует учитывать возможность образования сгустков крови. Таким образом, интервал между введением антифибринолитиков после препарата Фейба должен составлять не менее 6-12 часов.
При комбинированном применении рекомбинантного фактора VIIa и препарата Фейба нельзя исключать риск потенциального лекарственного взаимодействия согласно имеющимся данным и клиническим наблюдениям, в частности, риск развития тромбоэмболического осложнения.
Препарат Фейба не следует смешивать с другими лекарственными препаратами, так как это может повлиять на эффективность и безопасность использования препарата. Рекомендуется до и после введения препарата Фейба промывать общий венозный доступ стерильным изотоническим раствором хлорида натрия.
Хранение
При температуре 2–8 °C (не замораживать). В пределах указанного срока можно хранить при комнатной t (до 25 °C) в течение 6 мес.
Хранить в недоступном для детей месте.
Особые условия хранения
Хранить при температуре от 2°С до 8°С. Не замораживать. Хранить в недоступном для детей месте.
Состав и форма выпуска
Лиофилизат
Активное вещество: антиингибиторный коагулянтный комплекс.
1 флакон содержит 500 ЕД активности антиингибиторного коагулянтного комплекса, что соответствует 200 - 600 мг белка плазмы человека.
Вспомогательные вещества: хлорид натрия и цитрат натрия.
Растворитель: вода для инъекций.
Препарат Фейба содержит факторы II, IX и Х преимущественно в неактивированной форме, а также активированный фактор VII; коагулянтный антиген фактора VIII (FVIII C: Ag) и факторы калликреин-кининовой системы (система метаболического взаимодействия) присутствуют в следовых количествах или отсутствуют совсем.
Фармакотерапевтическая группа
Гемостатик
Лекарственная форма
Лиофилизат для приготовления раствора для инфузий 500 ЕД, 1000 ЕД ((флаконы в комплекте с растворителем - вода для инъекций 20 мл (флаконы), набор для растворения и введения (устройство BAXJECT II Hi – Flow для смешивания, одноразовый шприц N1, одноразова
Побочные действия
Частые побочные эффекты (наблюдаются у 1 из 10 человек):
гиперчувствительность;
головная боль;
головокружение;
низкое артериальное давление;
сыпь;
положительный тест на поверхностные антитела к гепатиту В.
Побочные эффекты с неизвестной частотой (невозможно рассчитать по имеющимся данным)
Нарушения со стороны крови и лимфатической системы: серьезное нарушение свертываемости крови (ДВС), повышенный титр ингибиторов.
Нарушения со стороны иммунной системы: анафилактические реакции, крапивница.
Нарушения со стороны нервной системы: онемение в руках и ногах (гипоэстезия), ненормальная или сниженная чувствительность кожи (парестезия), инсульт (тромботический инсульт, эмболический инсульт), сонливость (бессонница), изменение вкусовых ощущений (дисгевзия).
Нарушения со стороны сердца: сердечный приступ (инфаркт миокарда), учащенное сердцебиение (тахикардия).
Нарушения со стороны кровеносных сосудов: сгустки крови, попадающие в сосуды (тромбоэмболические осложнения, венозный и артериальный тромбоз), повышенное артериальное давление (гипертония), покраснение.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (пространство между легкими, например, трахеей, пищеводом, сердцем и т. д.): обструкция легочной артерии (тромбоэмболия легочной артерии), пароксизмы дыхательных путей (бронхоспазм), хрипы, кашель, одышка.
Нарушения со стороны желудочно-кишечного тракта: рвота, диарея, боль в животе, тошнота.
Нарушения со стороны кожы и подкожных тканей: онемение лица, отечность лица, языка и губ (ангионевротический отек), крапивница всего тела, зуд.
Общие нарушения в месте ведения препарата: боль в месте инъекции, чувство недомогания, жар, мурашки, лихорадка, боль в груди, дискомфорт в груди
Исследования: снижение артериального давления.
Быстрое внутривенное введение может вызвать острую боль, онемение лица и конечностей, а также выраженное снижение артериального давления.
Обнаружено, что инфаркт миокарда отмечался при введении доз, превышающих рекомендованные максимальные суточные дозы, и/или при длительном применении, и/или при наличии факторов риска развития тромбоэмболии.
Показания
Лечение кровотечений у пациентов с ингибиторной формой гемофилии А.
Лечение кровотечений у пациентов с ингибиторной формой гемофилии В, при отсутствии специфического лечения.
Лечение пациентов с приобретенными коагулопатиями вследствие ингибиторов к фактору VIII.
Профилактика кровотечений у пациентов с ингибиторной формой гемофилии А, перенесших массивные кровотечения и имеющих риск значительных кровотечений.
Нозологическая классификация
- D66 Наследственный дефицит фактора VIII
- D67 Наследственный дефицит фактора IX
- D68.2 Наследственный дефицит других факторов свертывания
- R58 Кровотечение, не классифицированное в других рубриках
Меры предосторожности
Не рекомендуется комбинировать с антифибринолитическими средствами (эпсилон-аминокапроновая кислота).
Характеристика
Антиингибиторный коагулянтный комплекс со стандартной активностью FEIBA (Factor Eight Inhibitor Bypass Activity). 1 мг белка содержит от 0,7 до 2,5 МЕ ФЕЙБА, факторы II, IX и X (в основном в неактивированной форме), активированный фактор VII, VIII (в концентрации до 0,1 МЕ на 1 МЕ ФЕЙБА). Плазма, применяемая для производства препарата, проходит обязательную проверку на АЛТ, а также на отсутствие HBsAg, анти-HCV, HIV-1 и HIV-2 антител.
Срок годности
2 года. 4 года растворитель
Не применять по истечении срока годности, указанного на упаковке.
Форма выпуска
Все фото Фейба