Иммунат
Инструкция Иммунат
Гемостатик
Противопоказания
— повышенная чувствительность к компонентам препарата.
Фармакодинамика
Иммунат представляет собой высокоочищенный лиофилизированный концентрат комплекса факторов свертывания крови VIII и Виллебранда, приготовленный из человеческой плазмы, дважды вирус инактивированный (обработка горячим паром и сольвент-детергентная обработка).
Комплекс фактор VIII/фактор Виллебранда состоит из 2 молекул, фактора VIII (фVIII) и фактора Виллебранда (фВ), с различными физиологическими функциями. Активированный фактор VIII является кофактором активации фактора IX, который ускоряет переход фактора X в активированный фактор X. Активированный фактор X необходим для превращения протромбина в тромбин. Тромбин, в свою очередь, превращает фибриноген в фибрин, и формируется сгусток. Гемофилия А - наследственное сцепленное с полом нарушение свертывающей системы крови, обусловленное дефицитом фVIII, в результате которого у больных развиваются профузные кровотечения или кровоизлияния в суставы, мышцы или внутренние органы как в результате травм и хирургических вмешательств, так и спонтанно. Заместительная терапия повышает содержание фVIII в плазме и тем самым временно корректирует дефицит фактора и снижает тенденцию к кровоточивости.
ФВ кроме функции белка, стабилизирующего фVIII в плазме, способствует адгезии
тромбоцитов к месту повреждения сосуда, участвует в агрегации тромбоцитов и необходим для заместительной терапии у пациентов с болезнью Виллебранда.
Фармакокинетика
Все фармакокинетические параметры лекарственного средства ИММУНАТ были измерены у больных с тяжелой формой гемофилии А (уровень фактора VIII ≤ 1%). Анализ
образцов плазмы проводился в центральной лаборатории методом хромогенного анализа фактора VIII. Фармакокинетические параметры, полученные в результате перекрестного исследования лекарственного средства ИММУНАТ у 18 ранее леченых пациентов старше 12 лет, перечислены в таблице.
Фармакокинетические параметры лекарственного средства ИММУНАТ у 18 пациентов с тяжелой формой гемофилии А (доза = 50 МЕ/кг):
-
Параметр
Среднее
Стандартное отклонение
Медиана
Доверительный интервал 90%
AUC0- ([МЕ х ч/мл])
12,2
3,1
12,4
11,1 – 13,2
Смакс (МЕ/мл)
1,0
0,3
0,9
0,8 – 1,0
Тмакс (ч)
0,3
0,1
0,3
0,3- 0,3
Конечное время
полувыведения Т½ (ч)
12,7
3,2
12,2
10,8 – 15,3
Клиренс (мл/ч)
283
146
232
199 - 254
Среднее время циркуляции
MRT (ч)
15,3
3,6
15,3
12,1 – 17,2
Объем распределения Vss (мл)
4166
2021
3613
2815 - 4034
Инкремент восстановления ([МЕ/мл]/(МЕ/кг])
0,020
0,006
0,019
0,016 – 0,020
Фармакологическое действие
Иммунат представляет собой высокоочищенный лиофилизированный концентрат комплекса факторов свертывания крови VIII и Виллебранда, приготовленный из человеческой плазмы, дважды вирусинактивированный (обработка горячим паром и сольвент-детергентная обработка).
Комплекс фактор VIII/фактор Виллебранда состоит из 2 молекул, фактора VIII (фVIII) и фактора Виллебранда (фВ), с различными физиологическими функциями. Активированный фактор VIII является кофактором активации фактора IX, который ускоряет переход фактора X в активированный фактор X. Активированный фактор X необходим для превращения протромбина в тромбин. Тромбин, в свою очередь, превращает фибриноген в фибрин, и формируется сгусток. Гемофилия А - наследственное сцепленное с полом нарушение свертывающей системы крови, обусловленное дефицитом фVIII, в результате которого у больных развиваются профузные кровотечения или кровоизлияния в суставы, мышцы или внутренние органы как в результате травм и хирургических вмешательств, так и спонтанно. Заместительная терапия повышает содержание фVIII в плазме и тем самым временно корректирует дефицит фактора и снижает тенденцию к кровоточивости.
ФВ кроме функции белка, стабилизирующего фVIII в плазме, способствует адгезии тромбоцитов к месту повреждения сосуда, участвует в агрегации тромбоцитов и необходим для заместительной терапии у пациентов с болезнью Виллебранда.
Применение у детей
Следует с осторожностью применять у детей до 6 лет, редко получавших лечение препарата фVIII.
При беременности и кормлении
Контролируемые исследования, подтверждающие безопасность применения концентратов фактора свертывания VIII человека при беременности и в период лактации, не проводились. Поэтому при беременности и в период лактации препарат следует назначать только по строгим показаниям.
Дозировка
Препарат после приготовления раствора вводится в/в медленно. Терапия должна начинаться под наблюдением врача, имеющего опыт лечения гемофилии. Дозы и продолжительность заместительной терапии зависят от степени дефицита фVIII, локализации, интенсивности кровотечения и тяжести клинического состояния больного. Количество вводимого фVIII выражается в Международных Единицах (ME), которые соответствуют общепринятому стандарту ВОЗ для препаратов, содержащих фVIII. Активность фVIII в плазме выражается или в процентах (соответствует нормальной плазме человека), или в Международных Единицах (соответствует Международному Стандарту для фVIII в плазме).
Одна Международная Единица (ME) активности фVIII эквивалентна такому же количеству фVIII в 1 мл нормальной плазмы человека.
А. Расчет дозы при гемофилии АРасчет требуемой дозы фVIII основывается на эмпирически установленном факте, что при введении 1 ME фVIII на кг массы тела активность фVIII в плазме повышается на 2% от нормальной активности. Доза препарата рассчитывается по следующей формуле: Необходимая доза Иммуната (ME фVIII) = масса тела (кг) х желаемое повышение фVIII (в%) х 0,5.
В каждом конкретном случае количество вводимого препарата и частота введения должны соотноситься с клинической эффективностью.
Кровотечения и хирургические вмешательства
В случае нижеперечисленных геморрагических эпизодов активность фактора VIII в плазме не должна быть ниже рекомендуемой.
|
Тяжесть кровотечения/объем хирургического вмешательства |
Необходимый уровень фактора VIII в плазме (%) (МЕ/дл) |
Кратность введения/длительность терапии |
|
Начальные признаки гемартроза, кровоизлияния в мышцы или кровотечение в полости рта |
20-40 |
Повторное в/в медленное введение каждые 12-24 ч. Не менее 1 сут; до купирования кровотечения (о чем свидетельствует отсутствие болей) или заживления. |
|
Выраженный гемартроз, кровоизлияние в мышцы или гематома |
30-60 |
Повторное медленное в/в введение каждые 12-24 ч в течение 3-4 сут или более до полного купирования болей и восстановления двигательной активности. |
|
Угрожающие жизни кровотечения |
60-100 |
Повторное медленное в/в введение каждые 8-24 ч до ликвидации угрозы жизни. |
|
Малые хирургические вмешательства, включая экстракцию зубов |
30-60 |
Каждые 24 ч, не менее 1 сут, до заживления. |
|
Большие хирургические вмешательства |
80-100 (до и после операции) |
Повторное медленное в/в введение каждые 8-24 ч до адекватного заживления раны, затем терапия в течение не менее 7 сут для поддержания активности фактора VIII на уровне 30-60% (МЕ/дл) |
Количество и частота введения препарата должны быть в соответствии с клиническим ответом в каждом конкретном случае.
В течение курса лечения рекомендуется определять активность фVIII в плазме с целью коррекции дозы и частоты введения препарата. Точный мониторинг заместительной терапии на основании данных коагулогических исследований (активность фVIII в плазме), особенно необходим при больших хирургических вмешательствах. Отдельные пациенты могут отличаться по их ответу на фVIII и демонстрировать различный уровень выхода препарата и период полувыведения.
Педиатрическая популяция
Следует с осторожностью применять у детей до 6 лет, редко получавших лечение препаратами фVIII, поскольку доступны лишь ограниченные данные по этой группе пациентов.
Длительная профилактика
Для длительной профилактики при тяжелых формах гемофилии А рекомендуются дозы 20-40 МЕ фVIII на кг массы тела каждые 2-3 сут. В некоторых случаях, особенно у пациентов младшего возраста, для профилактики геморрагии может потребоваться уменьшение интервалов между введениями или увеличение доз препарата.
B. Ингибиторные формы гемофилии АЕсли не удается достичь ожидаемого повышения активности фактора в плазме пациента или купировать кровотечение введением расчетных доз препарата, необходимо провести
исследование на наличие ингибиторов к фVIII. У пациентов с титром ингибиторов ниже
10 Бетезда Единиц (БЕ) на 1 мл ингибитор можно нейтрализовать дополнительным введением человеческого фVIII. У пациентов с титром ингибитора выше 10 БЕ/мл или с высоким ответом в анамнезе (high-responders) эффективно купировать кровотечения введением фVIII, как правило, не удается. В этих случаях следует проводить соответствующую специальную антиингибиторную терапию. Подобная терапия должна проводиться исключительно врачами, имеющими опыт лечения больных гемофилией.
C. Болезнь Виллебранда с дефицитом фактора VIIIИммунат показан в качестве заместительной терапии больным болезнью Виллебранда со сниженной активностью фактора VIII. Заместительная терапия Иммунатом с целью остановки и профилактики кровотечений, связанных с хирургическими вмешательствами, проводится в соответствии с рекомендациями для больных гемофилией А.
Для растворения и введения лекарственного средства следует использовать только набор, содержащийся в упаковке. Раствор Иммуната готовится непосредственно перед введением. Раствор должен быть бесцветным или слегка желтоватым и прозрачным или слегка опалесцирующим. Нельзя использовать мутный раствор или раствор с включениями. Неиспользованный раствор подлежит соответствующей утилизации.
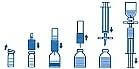
РастворениеСоблюдайте правила асептики!
-
Нагрейте закупоренный флакон с растворителем (стерильной водой для инъекций) до комнатной температуры (не выше 37°С).
-
Удалите защитные крышки с флаконов с концентратом и растворителем (рис. А) и продезинфицируйте резиновые пробки обоих флаконов.
-
Установите, а затем с нажимом наденьте волнистый край системы для переноса на флакон с растворителем (рис. В).
-
Удалите защитный колпачок с другого конца системы для переноса. Не касайтесь обнаженного конца системы.
-
Переверните флакон с растворителем над флаконом с сухим концентратом и проткните свободным концом иглы центр пробки флакона (рис. С). За счет вакуума, растворитель перетечет вo флакон с препаратом. Подождите примерно 1 мин.
-
Разъедините флаконы, вытащив иглу системы для переноса из пробки флакона с препаратом (рис. D). Т.к. препарат легко растворяется, слегка - если потребуется - покачайте флакон. Не трясите флакон с препаратом. Не переворачивайте флакон с препаратом до изъятия его содержимого.
-
Препараты для парентерального введения, такие как Иммунат, следует визуально обследовать на наличие включений и изменение цвета после приготовления раствора и перед введением. Даже в случае тщательного соблюдения инструкций по приготовлению раствора, изредка могут быть видны мелкие частицы. Они удаляются прилагаемым в комплекте фильтром. При этом концентрация фармацевтически активного ингредиента, указанная на этикетке, не снижается.
Соблюдайте правила асептики!
-
При заборе приготовленного раствора в шприц используйте прилагаемую фильтрующую иглу с целью избегания попадания частиц резиновой пробки (риск микроэмболии). Установите фильтрующую иглу на прилагаемый одноразовый шприц и проткните ею резиновую пробку (рис. Е).
-
Ненадолго снимите шприц с фильтрующей иглы. Воздух попадет внутрь флакона с раствором и осадит образовавшуюся пену. Затем наберите раствор через фильтрующую иглу в шприц (рис. F).
-
Снимите шприц с фильтрующей иглы и введите раствор в/в медленно (максимальная скорость введения - 2 мл/мин) с помощью прилагаемой системы или прилагаемой одноразовой иглы.
Любой неиспользованный остаток лекарственного средства необходимо утилизировать в соответствии с установленными требованиями.
Условия и сроки хранения восстановленного раствора: Химическая и физическая стабильность составляет 3 часа при комнатной температуре (не выше 25°С). С микробиологической точки зрения лекарственное средство следует использовать немедленно, кроме случаев, когда метод восстановления лекарственного средства исключает риск микробного загрязнения (контролируемые и валидированные асептические условия). Если восстановленный раствор не используется немедленно, то ответственность за сроки и условия хранения лекарственного средства, готового к использованию, возлагается на пользователя.
Восстановленное лекарственное средство нельзя возвращать в холодильник для хранения.
Передозировка
Симптомы передозировки неизвестны.
Относительно возможности тромбозов и гемолиза у пациентов с группами А(II), B(III) или АВ(IV) см. раздел «Особые указания».
Особые условия хранения
Развитие аллергических реакций возможно, как и на в/в введение любых белковых препаратов. В этих случаях следует немедленно прекратить введение препарата и проводить лечение в зависимости от реакции и ее тяжести. При легких реакциях назначаются противошоковые препараты, в тяжелых случаях проводится противошоковая терапия.
Пациенты с гемофилией А
Ингибиторы
Образование нейтрализующих антител (ингибиторов) к фактору VIII является известным осложнением при лечении пациентов с гемофилией А. Эти ингибиторы обычно являются IgG иммуноглобулинами, направлены против прокоагулянтной активности фактора VIII и измеряются в единицах Бетесда (БЕ) на мл плазмы (модифицированный метод Бетесда). Риск развития ингибиторов коррелирует с длительностью применения фактора свертывания VIII, причем риск наиболее высок в течение первых 20 дней применения. В редких случаях ингибиторы могут развиваться после первых 100 дней применения. Отмечены случаи рецидива (низкий титр антител) у ранее леченых пациентов, имевших более 100 дней введения, после перевода пациента с одного препарата фактора VIII на другой. Для своевременного выявления ингибиторов следует проводить тщательное клиническое наблюдение и лабораторное обследование больных, находящихся на лечении препаратами фактора свертывания VIII человека. Если ожидаемый уровень активности фактора VIII не достигается, или кровотечение не удается контролировать адекватной дозой, необходимо провести тестирование на развитие антител к фактору VIII.
Терапия фактором VIII может быть неэффективной у пациентов с высоким уровнем
антител, в таком случае должны быть рассмотрены другие варианты лечения. Контроль таких пациентов должен проводиться врачами, имеющими опыт лечения гемофилии с ингибиторами к фактору VIII.
Ингибиторы преимущественно наблюдались у пациентов, ранее не проходивших лечение. См. раздел «Побочные действия».
Пациенты с болезнью Виллебранда
Ингибиторы
У пациентов с болезнью Виллебранда, особенно Тип III, могут развиваться нейтрализующие антитела (ингибиторы) к фактору Виллебранда. Если не удается достичь желаемого уровня активности фактора Виллебранда в плазме, или кровотечение не контролируется соответствующей дозой лекарственного средства, необходимо провести исследования плазмы крови пациентов на наличие ингибиторов к фактору Виллебранда. Для пациентов с высоким уровнем ингибиторов, терапия фактором Виллебранда может быть неэффективна, поэтому необходимо предусмотреть другие способы лечения.
Случаи тромбозов
Существует риск развития тромболитических осложнений, особенно у пациентов с известными клиническими и лабораторными факторами риска. Поэтому, пациенты должны наблюдаться для выявления ранних признаков тромбоза. Необходимо применять профилактику против венозной тромбоэмболии согласно действующим медицинским стандартам. Поскольку лекарственное средство ИММУНАТ содержит относительно высокие количества фактора VIII по отношению к фактору Виллебранда, лечащий врач должен принять во внимание то, что продолжительное лечение лекарственным средством может стать причиной повышения уровня фактора свертывания крови VIII. У пациентов, принимающих лекарственное средство ИММУНАТ необходимо мониторировать уровень фактора VIII, чтобы избежать чрезмерного повышения уровня фактора VIII в плазме, который может увеличить риск тромбозов.
Иммунат производится из плазмы человека. При использовании плазмы или продуктов, приготовленных из человеческой плазмы, нельзя полностью исключить риск передачи инфекционных агентов, в т.ч. пока еще не известных. Однако риск передачи инфекционных агентов максимально снижен, благодаря следующим мерам:
тщательный медицинское обследование и отбор доноров и скрининговое тестирование отдельных доз и пулов плазмы на HbsAg и антитела к ВИЧ и гепатиту С;
исследование пулов плазмы на геномные последовательности вируса гепатита С;
включение в процесс производства обработки горячим паром и сольвент-детергентной обработки с целью удаления/инактивации вирусов, эффективность которых доказана на вирусах-моделях. Подтверждена эффективность данных методов в отношении ВИЧ-1, ВИЧ-2, гепатитов С, А и В.
Используемые в процессе производства методы удаления/инактивации вирусов могут быть частично эффективны в отношении некоторых безоболочечных вирусов, таких как парвовирус В19. Инфекция, вызванная парвовирусом В19 может привести к серьезному заболеванию у беременных женщин (инфицирование плода) и у пациентов с иммунодефицитом или повышенным распадом эритроцитов (например, при гемолитической анемии).
При лечении плазменными концентратами фVIII рекомендуется соответствующая вакцинация больных (против гепатитов А и В).
Содержание натрия в максимальной суточной дозе препарата составляет 200 мг, что следует учитывать у лиц, находящихся на гипо- и бессолевой диете.
Применение при беременности и лактации
Контролируемые исследования, подтверждающие безопасность применения концентратов фактора свертывания VIII человека при беременности и в период лактации, не проводились. Поэтому при беременности и в период лактации препарат следует назначать только по строгим показаниям.
Применение в детском возрасте
Следует с осторожностью применять у детей до 6 лет, редко получавших лечение препарата фVIII.
Влияние на способность к вождению автотранспорта и управлению механизмами Иммунат не оказывает действия на способность управления автомобилем и выполнения работы, требующей повышенной концентрации внимания и двигательной реакции.
Лекарственное взаимодействие
Взаимодействие препаратов фVIII человека с другими лекарственными средствами неизвестно.
Перед введением Иммунат нельзя смешивать с другими лекарственными средствами, что может ухудшить эффективность и безопасность препарата.
Желательно промывать общий венозный доступ изотоническим (физиологическим) раствором хлорида натрия перед и после введения Иммуната.
Особые условия хранения
Список Б. Препарат следует хранить в недоступном для детей месте при температуре от 2° до 8°С. Срок годности - 2 года.
Химическая и физическая стабильность готового раствора для в/в введения сохраняется в течение 3 ч при температуре 20-25°С.
С микробиологической точки зрения, препарат может включать риск микробного загрязнения, поэтому препарат следует использовать немедленно после растворения.
Если готовый раствор препарата не используется немедленно, то ответственность за время и условия хранения несет пользователь.
Состав и форма выпуска
В одном флаконе содержится:
активные вещества:
фактор свертывания крови VIII – 250 МЕ*; фактор Виллебранда – ≥190 МЕ**.
* - активность фактора VIII определялась в соответствии с Международным Стандартом (ВОЗ) для концентратов фактора VIII.
** - ристоцетин-кофакторная активность фактора Виллебранда определялась в соответствии с Международным Стандартом ВОЗ фактора Виллебранда. вспомогательные вещества: альбумин человеческий, глицин, лизина гидрохлорид, натрия хлорид, натрия цитрата дигидрат, кальция хлорида дигидрат.
растворитель: стерильная вода для инъекций – 5 мл.
Фармакотерапевтическая группа
Гемостатик
Лекарственная форма
Лиофилизат для приготовления раствора для в/в введения 250 МЕ, 500 МЕ, 1000 МЕ (флаконы) в комплекте с растворителем - вода для инъекций 5 мл, 10 мл (флаконы), шприцы, иглы
Побочные действия
В ответ на введение препаратов фактора VIII крайне редко наблюдались реакции повышенной чувствительности или аллергические реакции (в т.ч. ангионевротический отек, чувство жжения в месте инъекции, гиперемия кожи, крапивница, зуд, озноб, головная боль, артериальная гипотензия, сонливость, тошнота, рвота, беспокойство, тахикардия, чувство сдавления в груди, стридорозное дыхание) вплоть до развития аллергического шока. В редких случаях возможно повышение температуры тела.
У пациентов с гемофилией А могут развиться антитела к фактору VIII (ингибиторы), что клинически проявляется отсутствием гемостатического эффекта в ответ на проводимую терапию. В таких случаях следует проконсультировать пациента в специализированном гемофилическом центре.
Формирование нейтрализующих антител (ингибиторов) к фактору Виллебранда может развиваться у пациентов с болезнью Виллебранда, особенно у пациентов 3 типа. Наличие антител проявляется неадекватной клинической реакцией. Все пациенты с зафиксированной анафилактической реакцией должны быть протестированы на наличие антител. Во всех случаях рекомендуется связаться с врачом.
В ответ на введение высоких доз препарата у больных с группами крови А(II), В(III) или АВ(IV) может отмечаться гемолиз.
Побочные эффекты, основанные на отчетах клинических, в т.ч. постмаркетинговых исследованиях
Табличный перечень побочных реакций
Приведенная ниже таблица составлена согласно классификации систем органов MedDRA (классы систем органов и уровень предпочтительных терминов).
Частота побочных реакций оценивалась, исходя из следующих критериев: очень частые (>1/10), частые (>1/100; <1/10), нечастые (>1/1000; <1/100), редкие (>1/10000; <1/1000), очень редкие (<1/10000) и частота неизвестна (частоту невозможно определить на основании имеющихся данных).
Из перечисленных в следующей таблице побочных реакций гиперчувствительность наблюдалась в ходе клинического исследования, все остальные побочные реакции взяты из опыта пострегистрационного применения препарата.
-
Класс систем органов по стандарту MedDRA
Побочная реакция
Частота
Нарушения со стороны иммунной системы
Гиперчувствительность
Нечастые*
Нарушения со стороны крови и лимфатической системы
Ингибирование фактора VIII
Нечастые (РЛП)**
Очень частые (РНП)**
Коагулопатия
Неизвестна
Психиатрические нарушения
Беспокойство
Неизвестна
Нарушения со стороны нервной системы
Парестезия
Неизвестна
Головокружение
Неизвестна
Головная боль
Неизвестна
Нарушения со стороны органа зрения
Конъюнктивит
Неизвестна
Нарушения со стороны сердца
Тахикардия
Неизвестна
Пальпитация
Неизвестна
Нарушения со стороны сосудов
Гипотензия
Неизвестна
Приливы крови
Неизвестна
Бледность
Неизвестна
Нарушения со стороны дыхательной системы,
органов грудной клетки и средостения
Одышка
Неизвестна
Кашель
Неизвестна
Нарушения со стороны желудочно- кишечного тракта
Рвота
Неизвестна
Тошнота
Неизвестна
Нарушения со стороны кожи и подкожных тканей
Крапивница
Неизвестна
Сыпь (в т.ч. эритематозная и папулезная)
Неизвестна
Зуд
Неизвестна
Эритема
Неизвестна
Гипергидроз
Неизвестна
Нейродерматит
Неизвестна
Нарушения со стороны скелетно-мышечной и соединительной ткани
Миалгия
Неизвестна
Общие расстройства и нарушения в месте
введения
Боль в груди
Неизвестна
Дискомфорт в груди
Неизвестна
Отек (включая периферический, век и лица)
Неизвестна
Гипертермия
Неизвестна
Озноб
Неизвестна
Реакции в месте введения (включая жжение)
Неизвестна
Боль
Неизвестна
* один случай реакции гиперчувствительности в 329 инфузиях в одном клиническом исследовании на 5 пациентах.
** частота определялась в исследованиях со всеми продуктами, содержащими фVIII, включая пациентов с тяжелой гемофилией А. РЛП – ранее леченные пациенты, РНП – ранее не леченные пациенты.
Показания
лечение и профилактика кровотечений при наследственных (гемофилия А) и приобретенных дефицитах фVIII;
лечение кровотечений у пациентов с болезнью Виллебранда с недостаточностью фактора VIII, если лечение болезни Виллебранда специфическими препаратами неэффективно и в случае если монотерапия десмопрессином неэффективна или противопоказана.
Форма выпуска
Лиофилизат для приготовления раствора для в/в введения белого или белого с желтоватым оттенком цвета, без инородных частиц.
| фактор свертывания крови VIII | |
| фактор Виллебранда | ≥500 МЕ** |
Вспомогательные вещества: альбумин человека, глицин, лизина гидрохлорид, натрия хлорид, натрия цитрата дигидрат, кальция хлорида дигидрат.
Растворитель: вода д/и - 10 мл.
* - активность фактора VIII определялась в соответствии с Международным Стандартом (ВОЗ) для концентратов фактора VIII.
** - коллаген-связывающая активность фактора Виллебранда определялась в соответствии со Стандартом плазмы Комитета по стандартизации Международного Общества по Тромбозу и Гемостазу.
Флаконы (1) в комплекте с растворителем (фл. 1 шт.), комплектом для растворения и введения препарата (игла-фильтр для переноса, одноразовый шприц, игла-"бабочка" для трансфузии, стерильная игла для инъекций) - пачки картонные.
Лиофилизат для приготовления раствора для в/в введения белого или белого с желтоватым оттенком цвета, без инородных частиц.
| фактор свертывания крови VIII | |
| фактор Виллебранда | ≥125 МЕ** |
Вспомогательные вещества: альбумин человека, глицин, лизина гидрохлорид, натрия хлорид, натрия цитрата дигидрат, кальция хлорида дигидрат.
Растворитель: вода д/и - 5 мл.
* - активность фактора VIII определялась в соответствии с Международным Стандартом (ВОЗ) для концентратов фактора VIII.
** - коллаген-связывающая активность фактора Виллебранда определялась в соответствии со Стандартом плазмы Комитета по стандартизации Международного Общества по Тромбозу и Гемостазу.
Флаконы (1) в комплекте с растворителем (фл. 1 шт.), комплектом для растворения и введения препарата (игла-фильтр для переноса, одноразовый шприц, игла-"бабочка" для трансфузии, стерильная игла для инъекций) - пачки картонные.
Лиофилизат для приготовления раствора для в/в введения белого или белого с желтоватым оттенком цвета, без инородных частиц.
| фактор свертывания крови VIII | |
| фактор Виллебранда | ≥250 МЕ** |
Вспомогательные вещества: альбумин человека, глицин, лизина гидрохлорид, натрия хлорид, натрия цитрата дигидрат, кальция хлорида дигидрат.
Растворитель: вода д/и - 5 мл.
* - активность фактора VIII определялась в соответствии с Международным Стандартом (ВОЗ) для концентратов фактора VIII.
** - коллаген-связывающая активность фактора Виллебранда определялась в соответствии со Стандартом плазмы Комитета по стандартизации Международного Общества по Тромбозу и Гемостазу.
Флаконы (1) в комплекте с растворителем (фл. 1 шт.), комплектом для растворения и введения препарата (игла-фильтр для переноса, одноразовый шприц, игла-"бабочка" для трансфузии, стерильная игла для инъекций) - пачки картонные.
Все фото Иммунат